
【题目】氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种“反应物”在40~50 ℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。下列有关推断中错误的是()
A.这里的"另一种反应物"具有还原性B.CuH可作氧化剂、还原剂
C.CuH+Cl2![]() CuCl+HCl(燃烧)D.CuH+HCl
CuCl+HCl(燃烧)D.CuH+HCl![]() CuCl+H2↑(常温)
CuCl+H2↑(常温)
【答案】C
【解析】
Cu元素的化合价由+2价降低为+1价,在反应中CuSO4作氧化剂;CuH中Cu元素为+1价,既能升高又能降低;CuH在氯气中能燃烧,Cu元素的化合价升高,Cl元素的化合价降低;CuH跟盐酸反应能产生气体,气体为氢气。
A、Cu元素的化合价由+2价降低为+1价,在反应中CuSO4作氧化剂,则“另一种反应物”在反应中作还原剂,具有还原性,故A正确;
B、CuH中Cu元素为+1价,既能升高又能降低,所以CuH既可做氧化剂也可做还原剂,故B正确;
C、CuH在氯气中能燃烧,Cu元素的化合价升高,Cl元素的化合价降低,则发生2CuH+3Cl2═2CuCl2+2HCl↑,故C错误;
D、CuH跟盐酸反应能产生气体,气体为氢气,该反应中只有H元素的化合价发生变化,反应为CuH+HCl═CuCl+H2↑,故D正确。
答案选C。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.透明的溶液中: Fe3+、Al3+、CO32-、SO42-
C.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
D.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
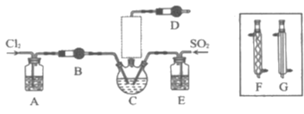
【题目】随着5G时代的到来,半导体材料将迎来快速发展,三氯化氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室利用PCl3、SO2、Cl2在60~65°C时反应制备POCl3和SOCl3的实验装置如图所示(气体的制备装置未画出)。
资料卡片:
物质 | 熔点/°C | 沸点/°C | 其他 |
PCl3 | -93.6 | 76.1 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl3 |
SOCl3 | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
(1)该反应的化学方程式为___。
(2)A、B装置中的试剂分别是___、___。
(3)装置E的作用是___。
(4)反应装置的虚线框中未画出的仪器最好选用___(填“F”或“G”),理由是___。
(5)反应结束后,提纯POCl3的操作是___(填操作名称)。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取4.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000molL-1的AgNO3溶液25.00mL,再加少许硝基苯,用力振荡。加入NH4Fe(SO4)2作指示剂,用0.l000molL-1KSCN标准溶液滴定过量的AgNO3至终点,消耗KSCN标准溶液22.00mL。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,Ag3PO4可溶于硝酸,POCl3的相对分子质量为153.5]
①加入少量的硝基苯的目的是___。
②POCl3的质量分数为___。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种芳香酯类物质,也是一种重要的香料,工业上合成它的一种方法如下图所示。图中D的相对分子质量为106,D、E的核磁共振氢谱均只有两个峰,B经过氧化可以得到C。

已知:![]() R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
R1CHO+HCOOH+R2CHO(R1、R2是烃基或者氢原子)。
(1)A的结构简式为___________________________,D的名称是___________________。
(2)D→E的反应类型为_______________,“一定条件”的内容是__________________。
(3)B中官能团的名称是__________,G的结构简式为___________________________。
(4)E→F的化学方程式为_________________。
(5)符合下列条件的F的同分异构体共有________种,写出一种核磁共振氢谱有5个峰的同分异构体的结构简式:________________________________。
①遇FeCl3溶液能发生显色反应 ②含有醚键
(6)写出以乙烯为原料合成HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组将高锰酸钾粉末与一定量铁粉混合隔绝空气加热,并在实验结束后对所得产物中不溶于水的黑色粉末X进行探究。
(探究目的)分析黑色粉末X的组成,并进行相关实验。
(猜想与假设)该黑色粉末可能含有铁粉、二氧化锰、四氧化三铁中的一种或几种。
(初步认证)将磁铁靠近黑色粉末,部分被吸引。
(初步结论)黑色粉末中_______含有MnO2,;_______含有Fe;________含有Fe3O4(填“一定”、“可能”或“一定不”)。
(定性检验)
实验步骤 | 实验操作 | 实验现象 |
步骤一 | 取少量黑色粉末于试管中,加足量稀硫酸,微热 | 黑色粉末部分溶解,无气泡产生 |
步骤二 | 将步骤一反应后试管中的物质过滤,向滤液中滴加几滴KSCN 溶液,振荡 | 溶液呈现红色 |
步骤三 | 取步骤二所得滤渣于试管中,加足量浓盐酸,加热 | 滤渣全部溶解,有黄绿色气体产生 |
步骤三中产生气体的离子方程式为___________________________________________。
(定量检验)
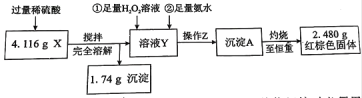
①操作Z的名称是__________,下图的仪器中,在灼烧沉淀时必须用到的是____________(填字母)。

②有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示)__________________________________________。
③通过以上数据,得出4.116 g黑色粉末X中各成分的物质的量为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )

A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是_________。
②步骤3生成MgCO3·nH2O沉淀的化学方程式为__________。
③步骤4检验沉淀是否洗涤干净的方法是__________。
(2)测定生成的MgCO3·nH2O中的n值。
称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
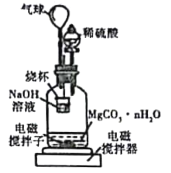
①图中气球的作用是_________。
②上述反应后期要升温到30℃,主要目的是______。
③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为_______。
(3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。
实验编号 | 1 | 2 | 3 | 4 |
消耗H2O2溶液体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①H2O2溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
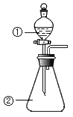
【题目】下列说法正确的是( )
A.节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明金属铝的熔点较低
C.将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是a%和b%的两种溶液,则a和b的关系是a=b
D.用如图装置进行实验,将装置①中的AlCl3溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com