
| A. | 热稳定性:HCl>HI | B. | 结合质子能力:S2->Cl- | ||
| C. | 原子半径:Ge>As | D. | 酸性:HNO2>HNO3 |
分析 A.非金属性氧气,对应氢化物的稳定性越强;
B.对应酸的酸性越强,阴离子结合质子的能力越小;
C.同一周期中,原子序数越大,原子半径越小;
D.根据N元素化合价越高,它的正电性越高,N-O-H中的电子向N越易偏移,O-H共价键越易断裂,越易电离出H+,酸性越强.
解答 解:A.非金属性Cl>I,非金属性越强,对应氢化物越稳定,则热稳定性:HCl>HI,故A正确;
B.对应酸的酸性越强,阴离子结合质子的能力越小,HCl的酸性较强,则结合质子能力:S2->Cl-,故B正确;
C.Ge、As位于同一周期,原子序数Ge<As,则原子半径:Ge>As,故C正确;
D.因为N元素化合价越高,它的正电性越高,N-O-H中的电子向N越易偏移,O-H共价键越易断裂,越易电离出H+,酸性越强,所以酸性HNO3>HNO2的原因为HNO3中N元素的化合价为+5价,高于HNO2中+3价的N元素,N的化合价越高,它的正电性越高,N-O-H中的电子向N越易偏移,O-H共价键越易断裂,越易电离出H+,酸性越强,则酸性:HNO2<HNO3,故D错误;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
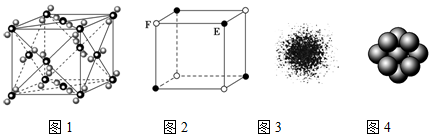
| A. | CO2 晶胞如图1所示,一个CO2 分子周围有12个CO2 分子紧邻 | |
| B. | 由E原子和F原子构成的气态团簇分子模型如图2所示,其分子式为EF或FE | |
| C. | H原子的电子云图如图3所示,H原子核外的大多数电子在原子核附近运动 | |
| D. | 金属Cu原子堆积模型如图4所示,该金属晶体为六方最密堆积,Cu原子的配位数为12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的硫酸溶液中含有的H+离子数为2NA | |
| B. | 常温下,11.2L甲烷气体含有的甲烷分子数为0.5NA | |
| C. | 22.4L NO2和CO2混合气体中含有的氧原子数为2NA | |
| D. | 标准状况下,18gH2O所含的氧原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述合成过程属于化学变化 | |
| B. | Cn元素位于元素周期表的第七周期,是副族元素 | |
| C. | Cn元素的相对原子质量为277 | |
| D. | 277112Cn的原子核内质子数比中子数多53 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
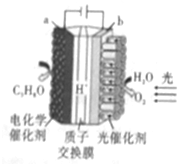 某模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法错误的是( )
某模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法错误的是( )| A. | 该装置工作时,H+从b极区向a极区迁移 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | a电极的反应式为3CO2+18H++18e-═C3H8O+5H2O | |
| D. | C3H8O和O2形成燃料电池以氢氧化钠作为电解质溶液的负极反应式:C3H8O-18e-+24OH-═3CO32-+16H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与FeCl 3溶液混合 | B. | CO通过灼热的Fe 2O 3 | ||
| C. | H 2通入FeSO 4溶液 | D. | Al和Fe 3O 4混合加热至高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、E一定处于三个不同的短周期 | |
| B. | A、D不可能在同一主族 | |
| C. | C的最高价氧化物对应的水化物可能显碱性 | |
| D. | C和D的单质不可能化合成1:1型离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
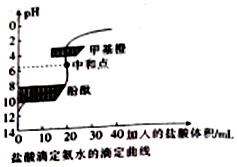
| A. | 该中和滴定适宜用酚酞作指示剂 | |
| B. | 两者恰好中和时,溶液的pH=7 | |
| C. | 达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com