
分析 2s后A的转化率为50%,则反应消耗的A为:2mol×50%=1mol,则
2A(g)+3B(g)?2C(g)+zD(g),
开始(mol) 2 2 0 0
转化(mol) 1 1.5 1 0.5z
2s后(mol) 1 0.5 1 0.5z
(1)根据c=$\frac{n}{V}$计算出C的物质的量浓度;
(2)根据反应消耗B的物质的量、B的初始物质的量计算出其转化率;
(3)根据v(C)=$\frac{\frac{△n}{V}}{△t}$计算出C的平均反应速率;
(4)根据反应速率与化学计量数成正比计算出z的值.
解答 解:2s后A的转化率为50%,则反应消耗的A为:2mol×50%=1mol,则
2A(g)+3B(g)?2C(g)+zD(g),
开始(mol) 2 2 0 0
转化(mol) 1 1.5 1 0.5z
2s后(mol) 1 0.5 1 0.5z
(1)此时C的物质的量浓度为:c(C)=$\frac{1mol}{2L}$=0.5mol/L,
答:此时C的浓度为0.5mol/L;
(2)B的转化率为:$\frac{1.5mol}{2mol}$×100%=75%,
答:B的转化率为75%;
(3)C的平均反应速率为:v(C)=$\frac{\frac{1mol}{2L}}{2s}$=0.25mol•L-1•s-1,
答:C的平均反应速率为0.25mol•L-1•s-1;
(4)因反应速率之比等于化学计量数之比,且v(D)=0.25mol•L-1•s-1,v(C)=0.25mol•L-1•s-1,则z:3=0.25mol•L-1•s-1:0.25mol•L-1•s-1,解得:z=3,
答:通过计算可知z的值为3.
点评 本题考查了化学平衡的计算,题目难度中等,涉及反应速率、转化率、物质的量浓度的计算,明确化学反应速率与化学计量数的关系为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
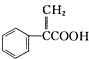
| A. | 阿托酸属于芳香烃化合物,与苯甲酸互为同系物 | |
| B. | 阿托酸分子中至少有6个碳原子处于同一平面上 | |
| C. | 1mol阿托酸最多能和1molBr2发生加成反应 | |
| D. | 阿托酸分子能发生取代、氧化、还原以及水解等反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
在标准状况下,等质量的CH4 和CO2比较,下列说法中正确的是
A.密度比4:11 B.分子数之比为4:11
C.体积比4:11 D.物质的量之比为4:11
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 0.1000mol•L1 HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 20.00 |
| 2 | 25.53 | 20.00 |
| 3 | 27.85 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为小于3NA | |
| B. | 0.1 mol Cl2完全溶于水,转移的电子数目为0.1NA | |
| C. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ,⑧
,⑧ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com