
分析 (1)Cr位于周期表第四周期ⅥB族,原子核外电子排布为1s22s22p63s23p63d54s1,失去3个电子生成Cr3+,配合物[Cr(H2O)6]3+中Cr3+为中心离子,H2O为配体;
(2)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子;
(3)H2O中心原子O原子价层电子对为2+2=4,VSEPR模型为四面体,由于含有2对孤电子对,故为V型,H2O与CH3CH3OH都含有氢键,且都为极性分子,二者互溶.
解答 解:(1)Cr位于周期表第四周期ⅥB族,原子核外电子排布为1s22s22p63s23p63d54s1,失去3个电子生成Cr3+,则离子的电子排布为1s22s22p63s23p63d3,
配合物[Cr(H2O)6]3+中Cr3+为中心离子,H2O为配体,O原子提供孤对电子,与Cr3+形成配位键,
故答案为:1s22s22p63s23p63d3;O;
(2)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2杂化,
故答案为:sp3和sp2;
(3)H2O中心原子O原子价层电子对为2+2=4,VSEPR模型为四面体,由于含有2对孤电子对,故为V型,H2O与CH3CH3OH都含有氢键,且都为极性分子,二者互溶,
故答案为:V型;H2O与CH3CH3OH之间可以形成氢键.
点评 本题综合考查原子结构与元素的性质,题目涉及核外电子排布、杂化类型以及等问题,侧重于学生的分析能力的考查,注意把握相关知识的判断方法,难度不大.


科目:高中化学 来源: 题型:解答题
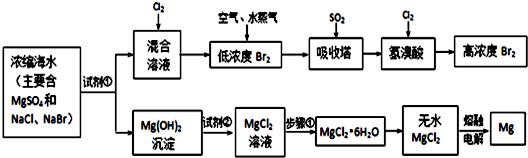
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

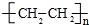 ,该反应属于加聚反应;
,该反应属于加聚反应;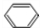 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$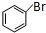 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4O | B. | CH3CH2OH | C. |  | D. | 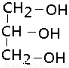 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-) 相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl 的质量分数为25.38% | |
| D. | 20℃时,100 g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| B | ||
| A | X | C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2,应密闭保存 | |
| D. | 氯气有漂白性,所以氯气能使有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,G的官能团名称是羧基
,G的官能团名称是羧基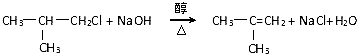 ;E与新制Cu(OH)2反应:
;E与新制Cu(OH)2反应: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com