
分析 ①Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=-441kJ•mol-1 a,
H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H2=+242kJ•mol-1 b,
Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H3=-602kJ•mol-1 c,
结合盖斯定律可知b+c-a得到Mg(OH)2(s)=MgO(s)+H2O(g);
②Mg(OH )2分解吸收热量.
解答 解:①Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=-441kJ•mol-1 a,
H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H2=+242kJ•mol-1 b,
Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H3=-602kJ•mol-1 c,
由盖斯定律可知b+c-a得到Mg(OH)2(s)=MgO(s)+H2O(g),则Mg(OH)2分解的热化学方程式Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81kJ•mol-1 ;
故答案为:Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81kJ•mol-1 ;
②Mg(OH )2可以作为阻燃剂的原因为Mg(OH )2分解要吸收大量的热,可以降低着火体系的温度,
故答案为:Mg(OH )2分解要吸收大量的热,可以降低着火体系的温度.
点评 本题考查热化学方程式的书写,为高频考点,把握盖斯定律的应用、热化学方程式的书写方法等为解答的关键,侧重分析与应用能力的考查,注意阻燃剂的原因,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
 (1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
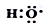 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同


| A. | (1)(2) | B. | (3)(5) | C. | (4)(5) | D. | (1)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 等物质的量的甲烷和一氧化碳所含的分子数前者大于后者 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 相同条件下的一氧化碳和氮气,若气体体积相等,则质量也相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的丁达尔效应与微粒直径大小有关 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作水的消毒剂 | |
| C. | 可用半透膜除去淀粉溶液中的少量NaCl | |
| D. | 向饱和氯化钠溶液中加入一小块钠,恢复原温度后溶液中有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的硬度一般比各组分金属的低 | B. | 合金中可能含有非金属元素 | ||
| C. | 合金中肯定含有金属元素 | D. | 合金的熔点一般比各组分金属的低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com