
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
考点: 化学反应中能量转化的原因;吸热反应和放热反应;反应热和焓变;用盖斯定律进行有关反应热的计算.
分析: 化学反应中一定伴随着能量变化,反应中既有放热反应,又有吸热反应,取决于反应物和生成物总能量的大小,生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,化学反应速率取决于物质的性质和外界反应条件,与反应是吸热还是放热没有必然的联系,反应热只取决于反应物和生成物总能量的大小,与反应条件无关.
解答: 解:A、生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故A错;
B、反应速率与反应是吸热还是放热没有必然的联系,故B错;
C、化学反应的反应热大小取决于反应物和生成物的总能量大小,与反应途径无关,应用盖斯定律,可计算某些难以直接测量的反应焓变,故C正确;
D、根据△H=生成物的焓﹣反应物的焓可知,焓变与反应条件无关,在光照和点燃条件下该反应的△H相同,故D错.
故选:C.
点评: 本题考查化学反应中能量的变化,着重于对概念的理解,注意放热反应、吸热反应与反应物、生成物以及反应速率、反应条件之间有无必然关系,做题时不要混淆.


科目:高中化学 来源: 题型:
在一定温度下的恒容容器中,反应A(s)+2B(g)⇌C(g)+D(g)已达平衡状态的是( )
|
| A. | 混合气体的压强不随时间变化而变化 |
|
| B. | 混合气体的密度不随时间变化而变化 |
|
| C. | 气体总物质的量不随时间变化而变 |
|
| D. | 单位时间内生成n mol C,同时消耗2n molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
由铜、锌和稀硫酸组成的原电池中(图1):
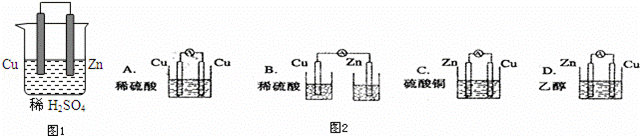
(1)锌是负极,电极反应式是 .铜是正极,电极反应式是 .总反应式
(2)在铜极上可以观察到 ,在锌极可以观察到 (填实验现象)
(3)图2装置能够组成原电池是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相同的甲乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是()
A. 若M(甲)>M(乙),则气体体积:甲<乙
B. 若M(甲)<M(乙),则气体压强:甲>乙
C. 若M(甲)>M(乙),则气体的摩尔体积:甲>乙
D. 若M(甲)<M(乙),则分子数:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
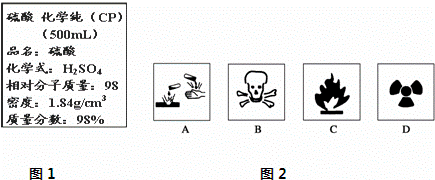
Ⅰ.现欲用该浓硫酸配制成1mol/L的稀硫酸.现实验室仅需要这种稀硫酸220mL.试回答下列问题:
(1)用量筒量取该浓硫酸 mL.
(2)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是 .
(3)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 .
(4)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是BCF.
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
Ⅱ.
(1)在盛放浓硫酸的试剂瓶的标签上应印有图2警示标志中的A.
(2)若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度 9.2mol/L(填>、<、=)
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是()
A. 未通电前上述镀锌装置可构成原电池,电镀过程是该电池的充电过程
B. 因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C. 电镀时保持电流恒定,升高温度不改变电解反应速率
D. 镀锌层破损后即对铁制品失去保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)⇌Si(g)+4HCl(g);△H=+Q kJ•mol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述 正确的是()
正确的是()
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C. 反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(L•min)
D. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1mol•L﹣1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生如下反应:
2SO2(g)+O2(g)⇌2SO3(g)+197kJ
实验测得有关数据如表:
容器编号 起始时各物质的物质的量/mol 达到平衡时体系能量的变化/KJ
SO2 O2 SO3
甲 2 1 0 Q1
乙 1.8 0.9 0.2 Q2
丙 0 0 2 Q3
下列判断中正确的是()
A. 197>Q2>Q1
B. 若升高温度,反应的热效应不变
C. Q3=﹣197kJ
D. 生成1mol SO3(l)时放出的热量大于98.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl﹣、Mg2+、Ba2+、CO32﹣、SO42﹣,现取三份100mL溶液进行下列实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到0.04mol气体;
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g;根据上述实验,推测100mL该溶液中一定存在的离子以及计算这些离子的物质的量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com