
【题目】铜及其化合物在工农业生产有着重要的用途,氯化铜、氯化业铜经常用作催化剂。其中CuCl广泛应用于化工和印染等行业。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15-25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)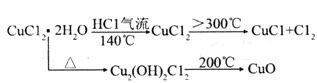
(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略)制备氯化铜。

①按气流方向连接各仪器接口顺序是:
a→_____、_____→_____、_____→_____、_____→_____。
②本套装置有两个仪器需要加热,加热的顺序为先_____后_______
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:_____________________。
(3)现欲从(2)所得溶液获得纯净的CuCl22H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3H2O C.CuO d.CuSO4
②要获得纯净CuCl22H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、_____、_____、洗涤、干燥。
(4)用CuCl22H2O为原料制备CuCl时,发现其中含有少量的CuCl2或CuO杂质,若杂质是CuCl2,则产生的原因是______________。
(5)设计简单的实验验证0.1mol/L的CuCl2溶液中的Cu2+对H2O2的分解具有催化作用:_____。
【答案】 d e h i f g b AD 2FeCl3+Cu=2FeCl2+CuCl2 c 冷却到26-42℃结晶(只答冷却结晶不得分) 过滤 加热温度低(加热时间不够) 取两支试管加入等体积等浓度的过氧化氢溶液一支加入几滴0.1mol/L的CuCl2溶液另一支加入几滴0.2mol/L的NaCl溶液滴加氧化铜溶液的试管产生的气泡速率快(其它合理答案也可)
【解析】试题分析:本题考查Cl2的实验室制备、装置的连接、物质的除杂、基本实验操作、实验方案的设计。
(1)①用装置A制备Cl2,制得的Cl2中混有HCl、H2O(g),所以将气体先通过盛饱和食盐水的装置C除去HCl,再通过盛浓H2SO4的装置E干燥Cl2,用纯净、干燥的Cl2与Cu反应制备CuCl2;由于Cl2会污染大气,最后用盛放NaOH溶液的装置B吸收尾气;同时注意洗气时导气管应长进短出;按气流方向连接各仪器接口顺序是:a→d、e→h、i→f、g→b。
②实验室用MnO2和浓盐酸加热制Cl2,Cu与Cl2加热反应制备CuCl2,则装置A和装置D需要加热;为了防止Cu与空气中的O2反应生成CuO,所以实验时必须先加热装置A产生Cl2,用生成的Cl2赶尽装置中的空气后再加热装置D。
(2)Cu与FeCl3溶液反应生成CuCl2和FeCl2,反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2。
(3)①向(2)所得溶液中加入H2O2溶液将Fe2+氧化成Fe3+,加入试剂X调节pH除去Fe3+。a项,加入NaOH可调节pH除去Fe3+,但引进新杂质Na+;b项,加入NH3·H2O可调节pH除去Fe3+,但引进新杂质NH4+;c项,加入CuO可调节pH除去Fe3+,且不引入新杂质;d项,加入CuSO4不能除去Fe3+;答案选c。
②根据题给资料(i)要获得CuCl2·2H2O需控制温度在26~42℃,所以要获得纯净CuCl2·2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、冷却到26~42℃结晶、过滤、洗涤、干燥。
(4)根据资料(ii),CuCl2·2H2O在HCl气流中加热到140℃失去结晶水生成CuCl2,继续加热到温度![]() 300℃时生成CuCl和Cl2,若发现CuCl中含有杂质CuCl2,产生的原因是:加热温度低(或加热时间不够)。
300℃时生成CuCl和Cl2,若发现CuCl中含有杂质CuCl2,产生的原因是:加热温度低(或加热时间不够)。
(5)要证明0.1mol/LCuCl2溶液中的Cu2+对H2O2的分解具有催化作用采用控制变量法,控制H2O2等浓度、等体积,两溶液中Cl-浓度相同;设计的简单实验为:取两支试管,加入等体积、等浓度的H2O2溶液,一支加入几滴0.1mol/L的CuCl2溶液,另一支加入几滴0.2mol/L的NaCl溶液,滴加CuCl2溶液的试管产生气泡速率快,说明Cu2+对H2O2的分解具有催化作用。


科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中加入4mol A和2mol B进行如下反应:3A(g)+2B(g)4C(s)+D(g),反应2min后达到平衡,测得生成1.6mol C,下列说法正确的是( )
A.前2 min D的平均反应速率为0.2 molL﹣1min﹣1
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列叙述中正确的是
A. 标准状况下,11.2 L CH3CH2OH 中含有的分子数目为0.5NA
B. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
C. 标准状况下,6. 72 L NO2与水充分反应转移的电子数目为0.1NA
D. 100g 46%的乙醇溶液中,含H-O键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)

A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.写出下列反应电极方程式
(1)(﹣)Zn|ZnSO4溶液||CuSO4|Cu(+),负极反应:________
(2)(﹣)Pb|H2SO4(浓)|PbO2(+) 正极反应:______________
(3)(﹣)H2(Pt)|KOH溶液|(Pt)O2(+) 负极反应:_____________
Ⅱ.某化学兴趣小组用下图所示装置进行电化学原理的实验探究,试回答下列问题:
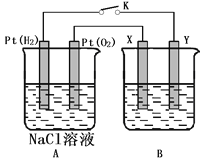
(1)通O2的Pt电极为电池_____________极(填电极名称),其电极方程式为_____________。
(2)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,则该电池阳极泥的主要成分是_______。
(3)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修5:有机化学基础】
尼龙-6(聚-6-氨基已酸)和尼龙-66(聚己二酸己二胺) 是两种常用的有机高分子纤维,是目前世界上应用最广、产量最大、性能优良的合成纤维。其合成路线如下:
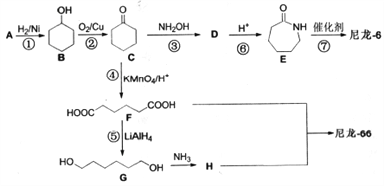
已知:a.A是一种常见的酸性工业原料b. 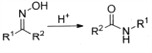
请回答以下问题:
(1)C与H中所含的官能团名称分别为_______、_______。
(2)A的结构简式为___________。
(3)合成路线中与D互为同分异构体的化合物是____(填写分子代号),与第②步的反应类型相同的反应步骤是___。
(4)合成尼龙-66的化学反应方程式为________ 。
(5)写出F的同分异构体中所有满足下列条件的物质的结构简式_______。
a.能发生水解反应,且1mol该物质能与2mol银氨溶液发生银镜反应;
b.能与碳酸氢钠溶液反应产生气泡;
c.核磁共振氢谱显示4组峰,氢原子个数比为1:1:2:6。
(6)因为分子结构中含有-NH2,这两种尼龙作为纺织材料时经常采用_____进行印染。(填“酸性染料“或“碱性染料”)
(7)结合上述合成路线,由已知化合物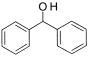 设计路线合成
设计路线合成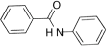 (其余小分子原料自选)。
(其余小分子原料自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有科学家预青,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
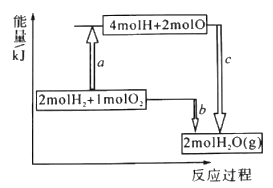
(1)已知破坏1moIH-H键、1molO=O键、1molH -O键时分别需要吸收436kJ、498kJ、465kJ的能量,下图表示H2、O2转化为H2O的反应过程中的能量变化,则b=_______。
(2)在l0lkPa下,lg氢气完全燃烧生成液态水放出142. 9kJ的热量,该反应的热化学方程式为_______。
(3)为探究实验室制氢气反应的热效应,选择下图装置进行实验。

①若x为水,y为生石灰,则实验过程中U形管中可观察到的现象是___________。
②若x为稀盐酸,y为锌粒,观察到与①相同的实验现象,则说明锌与稀盐酸制氢气的反应是_________(填“放热反应”或“吸热反应”)。
(4)已知:
H2SO4 (aq) +2KOH (aq)=K2SO4 (aq)+2H2O(1) △H =Q1kJ/mol
H2SO4(浓)+2NaOH(aq) =Na2SO4 (aq) +2H2O(1) △H =Q2 kJ/mol
HNO3 (aq)+KOH(aq)=KNO3 (aq)+H2O(l) △H =Q3 kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3值的大小关系为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com