
【题目】开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
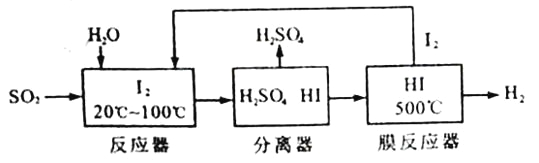
请回答下列问题:
(1)已知1gFeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______________。
(2)该循环工艺过程的总反应方程式为_____________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
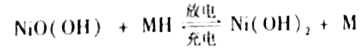
①电池放电时,负极的电极反应式为____________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为______________
科目:高中化学 来源: 题型:
【题目】肼( N2H4)是一种高能燃料,在工业生产中用途广泛。

(1)0.5mol肼中含有_________________mol极性共价键。
(2)工业上可用肼(N2H4)与新制Cu(OH)2反应制备纳米级Cu2O,同时放出N2该反应的化学方程式为___________________。
(3)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应成氮气与水蒸气。已知1.6g液态肼在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式____________________________。
(4)肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池正极反应式为_____________________,电池工作过程中,A极区溶液的pH___________________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )

A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的或者实验操作不正确的是
A. 定容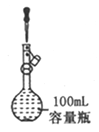
B. 比较硫、碳、硅三种元素
C. 处理尾气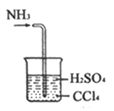
D. 测定黄铜(Cu、Zn素的非金属性强弱合金)中Zn的含量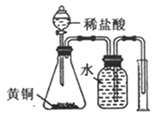
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
铁氧体是一种磁性材料,具有广泛的应用。 -
(1)基态铁原子的核外电子排布式为[Ar]_______。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是____________;醋酸钠中碳原子的杂化类型是_________。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因________。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
(4)下图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积______(填“是”或“否”),该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的_____空隙(填空间结构)。

(5)解释该Fe3O4晶体能导电的原因________,根据上图计算Fe3O4晶体的密度_____gcm-3。 (图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属和卤素的说法中,错误的是( )。
A.随着核电荷数的增大,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去电子的能力最弱,卤素中,氟原子得电子能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.溴单质与水反应比氯单质与水反应更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol、b mol碘化氢(a>b),待反应2HI(g)![]() I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
A. 从反应开始到建立平衡的平均速率:vA<vB
B. 平衡时I2的浓度:c(I2)A=c(I2)B
C. 平衡时碘蒸气在混合气体中的百分含置:A容器大于B容器
D. 平衡时HI的分解率:αA=αB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32 -、SO42 -、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32 -和SO42 -,一定不存在Fe3+
B. 是否存在Na+只有通过焰色反应才能确定
C. 原溶液一定存在Na+,可能存在Cl-
D. 若原溶液中不存在Cl-,则c (Na+) =0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常温下pH=2的醋酸溶液的叙述正确的是
A. c(CH3COOH)=0.01 mol·L-1
B. c(H+)=c(CH3COO-)
C. 加水稀释100倍后,pH=4
D. 加入醋酸钠固体,可抑制醋酸的电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com