
今有①盐酸、②醋酸、③硫酸三种稀溶液,用序号回答下列问题.
(1)若三种酸的物质的量浓度相等.
a.三种溶液中的c(H+)大小关系为 .
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为 .
(2)若三种酸溶液中的c(H+)相等.
a.三种酸的物质的量浓度大小关系为 .
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为 .
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
(1)三种酸的物质的量相等,
a.盐酸是一元强酸、硫酸是二元强酸、醋酸是一元弱酸,据此判断溶液中氢离子浓度大小;
b.消耗相同浓度NaOH溶液体积与酸的物质的量和元数成正比;
(2)三种酸中氢离子浓度相等,
a.氢离子浓度相等时,这三种酸中一元弱酸浓度最大、二元强酸浓度最小;
b.消耗相同浓度氢氧化钠溶液体积与氢离子的物质的量成正比.
解答:
解:(1)三种酸的物质的量相等,
a.盐酸是一元强酸、硫酸是二元强酸、醋酸是一元弱酸,相同浓度的这三种酸c(H+)大小关系为:③>①>②,故答案为:③>①>②;
b.消耗相同浓度NaOH溶液体积与酸的物质的量和元数成正比,相同浓度相同体积的三种酸,其物质的量相等,所以消耗相同浓度NaOH体积大小关系为③>①=②,故答案为:③>①=②;
(2)三种酸中氢离子浓度相等,
a.氢离子浓度相等时,这三种酸中一元弱酸浓度最大、二元强酸浓度最小,所以三种酸的物质的量浓度大小关系为②>①>③,故答案为:②>①>③;
b.等体积等氢离子浓度的这三种酸,硫酸和盐酸中氢离子的物质的量相等,醋酸的物质的量大于盐酸,所以消耗相同浓度氢氧化钠溶液体积大小关系为②>①=③,故答案为:②>①=③.
点评:
本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,易错点是(2)b,同体积、同氢离子浓度的盐酸和硫酸消耗同浓度NaOH体积与氢离子的物质的量有关,与酸的元数无关,为易错点.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
下列试剂的保存方式不正确的是( )
|
| A. | 金属钠保存在煤油中 |
|
| B. | HF溶液保存在棕色玻璃瓶中 |
|
| C. | 浓硫酸盛放在铝制容器中 |
|
| D. | 稀NaOH溶液保存在带橡胶塞的玻璃中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为 熔化时不需破坏化学键的是 ,熔化时只需破坏共价键的是 (填序号).
(2)在①H2、②(NH4)2SO4、③SiC、④CO2、⑤HF中,由极性键形成的非极性分子有 ,由非极性键形成的非极性分子有 ,能形成分子晶体的物质是 ,含有氢键的晶体的化学式是 ,属于离子晶体的是 ,属于原子晶体的是 .(填序号)
(3)如图表示一些晶体的结构中的某一部分.
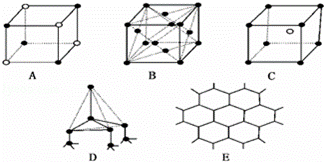
①代表金刚石的是(填编号字母,下同) ,其中每个碳原子与 个碳原子最接近且距离相等.
②代表NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个.
③代表CsCl的是 ,每个Cs+与 个Cl﹣紧邻.
④代表干冰的是 ,每个CO2分子与 个CO2分子紧邻.
⑤代表石墨的是 ,它属于 晶体.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知“凡气体分子总数增多的反应一定是熵增大的反应”.根据所学知识判断,下列反应中,在所有温度下都不自发进行的( )
|
| A. | 2O3(g)═3O2(g)△H<0 | B. | 2CO(g)═2C(s)+O2(g)△H>0 |
|
| C. | N2(g)+3H2(g)═2NH3(g)△H<0 | D. | CaCO3(s)═CaO(s)+CO2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应m A+n B⇌p C在某温度下达到平衡.
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 .
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向 方向移动.
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为 态.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作会导致实验结果偏高的是( )
A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B.中和滴定测定盐酸浓度,量取20.00mL盐酸时未用待测液润洗酸式滴定管
C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量
D.配制一定物质的量浓度溶液时,用量筒量取浓溶液体积仰视读数,所配溶液的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
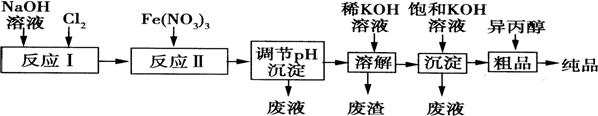
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整
pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于卤素的叙述正确的是 ( )
A、随核电荷数增加卤素原子非金属性增强
B、随核电荷数增加,单质熔沸点升高
C、随核电荷数增加,单质氧化性增强
D、单质与水反应,均可用通式X2+H2O=HX+HXO表示
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应N2(g)+O2(g)==2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
A.降低体系温度 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com