
【题目】能正确表达下列反应的离子方程式为( )
A. 用稀盐酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS===H2S↑+Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-===Al2(CO3)3↓
D. Na2O2溶于水产生O2∶Na2O2+H2O===2Na++2OH-+O2↑
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。

实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ________ | ________ |
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间可能包括多步反应,其总的离子方程式正确的是 ( )
A. 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O===HClO+HSO3-
B. 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 向 AlCl3溶液中投入过量Na:Al3++4Na+2H2O===AlO2-+4Na++2H2↑
D. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子。这4个原子生成数微秒后衰变成第113号元素。下列有关叙述正确的是
A. 115号元素在第六周期
B. 113号元素在第七周期ⅢA族
C. 115号和113号元素都是非金属元素
D. 镅元素和115号元素不在同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)等,一种综合利用工艺设计如下:
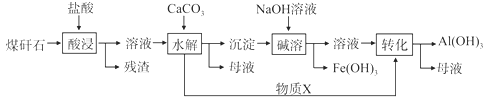
(1)物质X的化学式为__________________
(2)“酸浸”过程中主要反应的离子方程式为:________________,________________
(3)“碱溶”的目的是___________________
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算后填空:
(1)在标准状况下,448 mL某气体的质量为0.64 g,这种气体的相对分子质量为________。
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2 mol·L-1,c(Cl-)=1 mol·L-1。则c(Na+)为________。
(3)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(4)500mL Fe2(SO4)3溶液中含Fe3+ 28 g,则溶液中SO42-的物质的量浓度为________mol·L-1。
(5)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度________(填“大于”“等于”或“小于”)0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
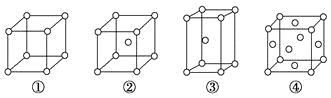
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com