
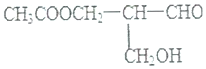
| A. | 与NaOH溶液共热 | B. | 与甲酸发生酯化反应 | ||
| C. | 与碱性Cu(OH)2悬浊液反应 | D. | 在催化剂存在下与H2作用 |
分析 在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则将这种碳原子称为“手性碳原子”,该分子中次亚甲基上C原子为手性碳原子,要使该物质发生反应后仍然具有活性,反应后的次亚甲基不能连接相同的取代基,据此分析解答.
解答 解:A.如果该物质和NaOH溶液共热后的产物中次亚甲基连接两个-CH2OH,所以没有手性碳原子,故A不选;
B.与甲酸发生酯化反应后的产物中次亚甲基连接-H、-CHO、-CH2OH、CH3COOCH2-,所以有手性碳原子,故B选;
C.与碱性Cu(OH)2悬浊液反应后的产物中次亚甲基两个-CH2OH,所以没有手性碳原子,故C不选;
D.在催化剂存在下与H2作用,醛基被还原生成-CH2OH,所以次亚甲基还原两个-CH2OH,没有手性碳原子,故D不选;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生信息获取能力、理解能力和应用能力,明确“手性碳原子”概念及物质结构和性质是解本题关键,注意C选项反应后酯基生成醇羟基,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 等物质的最浓度的H2S和NaHS混合溶液中:c(Na)+c(H+)=c(S2-)+c(HS-+c(OH-) | |
| B. | 0.2mol/LNH4C1溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下向20ml0.1mol/LNH4HSO4溶液中滴入同浓度的NaOH溶液至pH=7 c(Na+)>c(SO42-)c(NH4+) | |
| D. | 25℃时,pH=8 的 CH3COONa 稀溶液中,c(CH3COOH)=9.9×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | C | |
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3 | |
| B. | 由水溶液的酸性:HC1>HF,可推断出元素的非金属性:C1>F | |
| C. | 锗与硅位于金属与非金属的交界处,都能做半导体材料 | |
| D. | S和Se分别位于第VIA的第三、四周期,则氢化物稳定性:H2S>H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.6 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-55.6 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-889.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,溶液中OH- 移向正极 | |
| D. | 原电池工作时,溶液中电子由负极流向正极 |
查看答案和解析>>
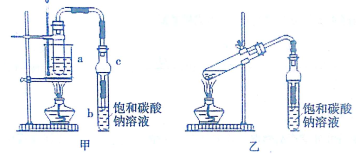
科目:高中化学 来源: 题型:实验题
| 试剂 | 乙醚 | 乙醇 | 甲酸 | 甲酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 100.5 | 54.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com