
| A. | 正反应速度一定大于逆反应速度 | B. | 反应物的转化率一定增大 | ||
| C. | 正反应速率一定增大 | D. | 生成物的质量分数一定增加 |
分析 影响化学平衡状态的因素有浓度、温度、压强等,外界条件不同,对平衡移动的影响不同,改变条件使化学平衡向正反应方向移动,则正反应速率一定大于逆反应速率,生成物的产量一定增加.
解答 解:A、正反应速率大于逆反应速率,平衡向正反应方向移动,故A正确;
B、如增加某反应物的物质的量,平衡向正方向移动,但该反应物的转化率反而减小,故B错误;
C、对放热反应降温,平衡正向移动,但正反应速率减慢,故C错误;
D、降低生成物浓度,化学平衡向正反应方向移动,生成物的产量增大,但物质的量分数减小,故D错误;
故选A.
点评 本题考查化学平衡的影响因素,题目难度中等,注意影响化学平衡移动的因素,解答时注意从勒沙特列原理的角度分析.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
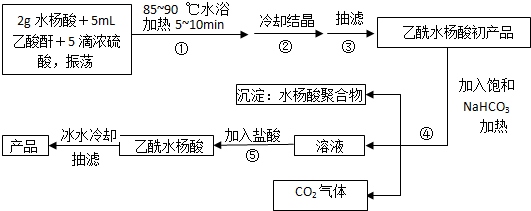
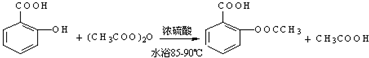 ;反应类型取代反应;
;反应类型取代反应; 、
、 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
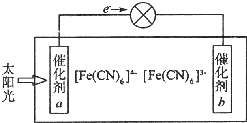 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 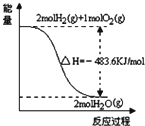 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为-241.8kJ•mol-1 | |
| B. | 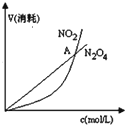 表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 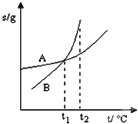 表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 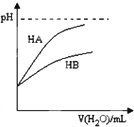 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化.则NaA溶液的pH小于等物质的量浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

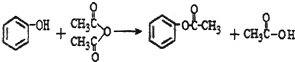
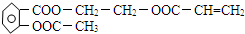 .
.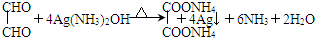
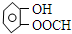 (或间、对位)
(或间、对位)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | NaHCO3和过量的澄清石灰水反应:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| D. | NH4HSO3溶液与足量NaOH溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B一定是同分异构体 | |
| B. | A和B不可能是同系物 | |
| C. | A和B的最简式相同 | |
| D. | A和B各1mol完全燃烧后生成的二氧化碳的质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
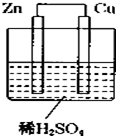 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )| A. | ②④⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com