
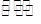 N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
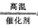 4NO+6H2O (2)2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l);△H=-87.0kJ/mol
4NO+6H2O (2)2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l);△H=-87.0kJ/mol

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
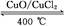 2Cl2+2H2O
2Cl2+2H2O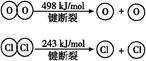
| A.反应A的ΔH>-115.6 kJ/mol |
| B.断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ |
| C.H2O中H—O键比HCl中H—Cl键弱 |
| D.由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:| 实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
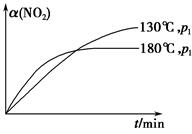
 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

 H=-570kJ/mol;
H=-570kJ/mol; H=-242kJ/mol;
H=-242kJ/mol;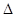 H=—110.5kJ/moL;
H=—110.5kJ/moL;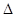 H=—393.5kJ/moL;
H=—393.5kJ/moL;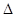 H=+890kJ/moL
H=+890kJ/moL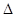 H=akJ/moL;则a= ;该反应的熵
H=akJ/moL;则a= ;该反应的熵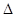 S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能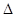 G=
G=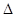 H—T
H—T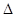 S,当
S,当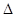 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。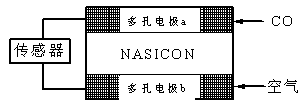
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
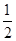 O2(g ) = CO2( g ) △H=─283.0 kJ / mol 。
O2(g ) = CO2( g ) △H=─283.0 kJ / mol 。| A.2:1 | B.1:2 | C.1:1 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。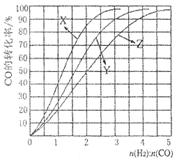
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-183 kJ·mol-1 | B.-91.5kJ·mol-1 |
| C.+183kJ·mol-1 | D.+ 91.5kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com