
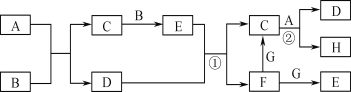
【题目】已知:苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢。根据以下转化关系(生成物中所有无机物均已略去),回答下列问题:
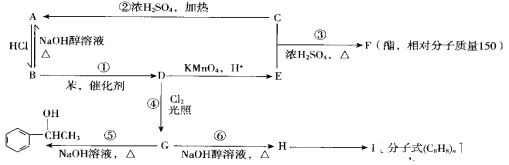
(1)E中官能团的名称是______,I的结构简式为__________。
(2)在①~⑥6个反应中,属于取代反应的是(填反应编号)______。
(3)写出⑥的化学方程式: ____。
(4)F的同分异构体有多种,其中符合下列条件的有__种。①与F具有相同的官能团②能发生银镜反应③苯环上有3个取代基,其核磁共振氢谱图为四组峰,且峰面积之比为6:2:1:1的结构简式为____(任写一种)。
(5)通常烯烃和卤化氢的加成遵循马氏规则,即:H加在含H多的碳原子上;在有过氧化氢作催化剂时,H会加在含H少的碳原子上。试参照上述合成路线,以![]() ,CH2=CHCH3为原料(无机试剂任选),设计合成路线制备
,CH2=CHCH3为原料(无机试剂任选),设计合成路线制备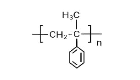 ________。
________。
【答案】羧基 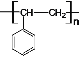 ①③④⑤
①③④⑤  6
6 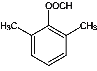 或
或
【解析】
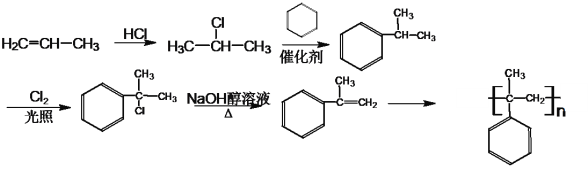
G通过反应⑤得到 ,而G由D与氯气在光照条件下得到的产物,可知G为卤代烃,在NaOH的水溶液中发生取代反应,得到醇,可知G的结构简式为
,而G由D与氯气在光照条件下得到的产物,可知G为卤代烃,在NaOH的水溶液中发生取代反应,得到醇,可知G的结构简式为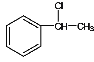 ;D的结构简式为
;D的结构简式为 ,苯的同系物与高锰酸钾作用得到苯甲酸,则E的结构简式为
,苯的同系物与高锰酸钾作用得到苯甲酸,则E的结构简式为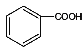 ,E和C反应得到酯类,且相对分子质量为150,则M(E)+ M(C)=150+18,则M(C)=46,则C为乙醇,结构简式为CH3CH2OH,乙醇在浓硫酸作催化剂的作用下,加热发生消去反应,A为乙烯,A与HCl发生加成得到一氯乙烷,即B,结构简式为CH3CH2Cl,B和苯在催化剂的作用下,得到D。G在NaOH醇溶液中,发生消去反应,得到H,为苯乙烯,结构简式为
,E和C反应得到酯类,且相对分子质量为150,则M(E)+ M(C)=150+18,则M(C)=46,则C为乙醇,结构简式为CH3CH2OH,乙醇在浓硫酸作催化剂的作用下,加热发生消去反应,A为乙烯,A与HCl发生加成得到一氯乙烷,即B,结构简式为CH3CH2Cl,B和苯在催化剂的作用下,得到D。G在NaOH醇溶液中,发生消去反应,得到H,为苯乙烯,结构简式为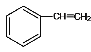 ,苯乙烯发生加聚反应得到I,结构简式为
,苯乙烯发生加聚反应得到I,结构简式为 。
。
(1)根据上述分析,E的结构简式为 官能团名称为羧基;苯乙烯发生加聚反应得到I,结构简式为
官能团名称为羧基;苯乙烯发生加聚反应得到I,结构简式为 ;
;
(2)反应①为氯乙烷和苯生成乙苯和氯化氢,取代反应;反应②为乙醇的消去反应;反应③为乙醇和苯甲酸的酯化反应,也是取代反应;反应④为乙苯和氯气在光照下的取代反应;反应⑤为氯代烃的水解反应,也是取代反应;反应⑥为氯代烃的消去反应;则取代反应的有①③④⑤;
(3)反应⑥为G在NaOH醇溶液中,发生消去反应,得到H,为苯乙烯;化学方程式为 ;
;
(4)F为苯甲酸乙酯,结构简式为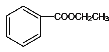 ,其同分异构体与F具有相同的官能团,则具有酯基,能发生银镜反应,但是分子中只有2个O原子,则为甲酸酯,含有-OOCH的结构,苯环上有3个取代基,除了苯环外,只有3个碳原子,则3个取代基分别为-OOCH、-CH3、-CH3,一共有6种同分异构体;其中峰面积之比为6:2:1:1,说明两个甲基处于对称位置,比例中才有6,结构简式为
,其同分异构体与F具有相同的官能团,则具有酯基,能发生银镜反应,但是分子中只有2个O原子,则为甲酸酯,含有-OOCH的结构,苯环上有3个取代基,除了苯环外,只有3个碳原子,则3个取代基分别为-OOCH、-CH3、-CH3,一共有6种同分异构体;其中峰面积之比为6:2:1:1,说明两个甲基处于对称位置,比例中才有6,结构简式为 或
或 ;
;
(5) 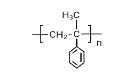 该物质与I类似,原料中有苯和丙烯,模仿A到I的路径;根据目标产物可知,丙烯的第二个C原子与苯环相连,则与HCl发生加成时,Cl在第二个C原子上,遵守马氏规则,其他步骤与图示类似,路径为
该物质与I类似,原料中有苯和丙烯,模仿A到I的路径;根据目标产物可知,丙烯的第二个C原子与苯环相连,则与HCl发生加成时,Cl在第二个C原子上,遵守马氏规则,其他步骤与图示类似,路径为 。
。


科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700 ℃,催化剂”)。G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体。
请回答下列问题:
(1)E的化学式为________________。
(2)A的电子式为________________。
(3)写出反应①的离子方程式:________________________________。
(4)写出反应②的化学方程式,并标出电子转移的方向与数目:
______________ __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g) + B(g)xC(g) + 2D(g),经4min后,测得D的浓度为0.4mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1 mol·(L ·min) -1。下列说法错误的是
A.A在4min末的浓度是0.6mol/LB.B在4min内的平均反应速率0.05 mol.L -1·min -1
C.x值是1D.起始时物质A的浓度为2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硫技术可用于处理废气中的氮氧化物。发生的化学反应为:2NH3(g)+NO(g)![]() 2N2(g)+3H2O(g) ΔH<0在恒容密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g) ΔH<0在恒容密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度平衡向正反应方向移动
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是
A.强酸与强碱中和滴定时可以选用甲基橙或酚酞作指示剂;强碱与弱酸中和滴定时应该选用酚酞作指示剂
B.在5![]() 的
的![]() 溶液中加入3mL等浓度的NaCl溶液,有白色沉淀产生,再加入3mL等浓度的
溶液中加入3mL等浓度的NaCl溶液,有白色沉淀产生,再加入3mL等浓度的![]() 溶液,溶液中又有黑色沉淀生成,说明
溶液,溶液中又有黑色沉淀生成,说明![]()
C.物质的量浓度均为![]() 的弱酸HX及其盐NaX溶液等体积混合后:
的弱酸HX及其盐NaX溶液等体积混合后:![]()
![]()
D.已知![]() ,
,![]() 。在含
。在含![]() 、
、![]() 浓度相同的溶液中滴加
浓度相同的溶液中滴加![]() 溶液时,首先生成
溶液时,首先生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com