
| A. | 通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极 | |
| B. | 放电一段时间后,电解质溶液中KOH的物质的量不改变 | |
| C. | 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移 | |
| D. | 放电时,通过甲烷的一极附近的pH降低 |
分析 甲烷碱性燃料电池工作时,正极发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,甲烷在负极发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,结合电极方程式以及题目要求可解答该题.
解答 解:A.根据原电池总反应式可知甲烷被氧化,应为原电池的负极反应,氧气得电子被还原,应为原电池的正极反应,通甲烷的电极(X)为电池的负极,通氧气的电极(Y)为电池正极,故A正确;
B.根据总方程式CH4+2O2+2OH-═CO32-+2H2O可知反应消耗KOH,KOH的物质的量改变,故B错误;
C.n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,转移电子的物质的量为0.25mol×4=1mol,故C正确;
D.甲烷在负极发生氧化反应,通过甲烷电极的电极反应为CH4+10OH--8e-=CO32-+7H2O,所以负极附近的pH降低,故D正确.
故选B.
点评 本题考查了燃料电池知识,燃料电池电极反应式的书写要注意结合电解质溶液书写,原料相同,电解质溶液不同,电极反应式不同,如氢氧燃料电池,电解质为酸或碱时,电极反应式就不同,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
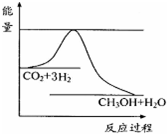 依据事实,写出下列反应的热化学方程式
依据事实,写出下列反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 向滴有酚酞的NaOH溶液中 通入SO2 | 溶液红色褪去 | SO2具有漂白性 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.| 化学键 | C=O | H-H | C-C | C-H | O-H | C-O |
| 键能/kJ、mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完成燃烧生成3molH2O | |
| C. | 1-丙醇和2-丙醇的一氯代物种类不同 | |
| D. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ① | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以惰性材料为电极,KOH溶液为电解质构成原电池,负极反应式为H2-2e-=2H+ | |
| B. | 铜、锌在稀硫酸溶液中构成原电池,正极反应式为2H++2e-=H2↑ | |
| C. | 以铜为电极将2Fe3++Cu=2Fe2++Cu2+设计成原电池,正极反应式为Cu-2e-=Cu2+ | |
| D. | 以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应式为Al-3e-=Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com