
【题目】草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O![]() CO↑+CO2↑+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
CO↑+CO2↑+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
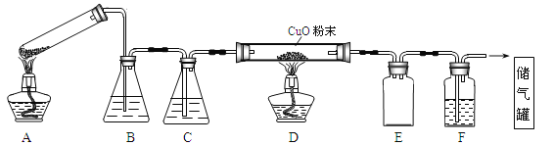
(1)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯。点燃D处酒精灯前必须要进行的操作名称是__________。这4步操作由先到后的顺序为______________(填序号)。
(2)A装置为加热分解草酸的装置,指出该装置一处错误:_______________________,B和F装置中盛放的试剂相同,其中溶质是__________ (填化学式),E装置的作用是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.08g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+= 10 CO2↑+2Mn2++8H2O。
①配制草酸溶液除需要胶头滴管、烧杯,还一定需要的玻璃仪器有_____________。
②x=________。
【答案】验纯 ①③④② 试管口应向下倾斜 NaOH 安全瓶(或防倒吸) 100mL容量瓶,玻璃棒 1
【解析】
草酸晶体受热分解为CO、CO2,用NaOH溶液除去CO2,用浓硫酸干燥后的CO通入D中,和CuO发生反应生成铜和CO2,E做安全瓶,起到防止F中的水进入D中的作用,F中装有NaOH溶液,用于除去生成的CO2,剩余的CO被收集起来。
(1)纯度不足时一氧化碳气体会发生爆炸,所以先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时,应该先熄灭D处酒精灯,然后再熄灭A处酒精灯;点燃D处酒精灯前必须要检验CO的纯度。所以正确的操作方法为:①③④②;避免发生爆炸现象,所以点燃D处酒精灯前必须要进行检验CO纯度;
(2)给试管中的固体加热时,试管口应该稍稍向下倾斜;根据图示装置及实验目的可知:B为澄清石灰水,目的是除去混合气体中二氧化碳,D为浓硫酸,目的是干燥CO气体;D中氧化铜与一氧化碳反应制取铜;E为安全瓶,起到防止倒吸的作用;F为氢氧化钠溶液,除去二氧化碳气体,最后收集CO气体;
(3)①配制草酸溶液除需要玻璃棒、烧杯,配制100mL溶液需要选用100mL容量瓶,定容时还需要胶头滴管,故答案为100mL容量瓶、胶头滴管;
②16mL 0.0500mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.0500mol/L×0.016L=0.0008mol,100mL该草酸溶液能够消耗高锰酸钾的物质的量为:0.0008mol×![]() =0.004mol,根据反应2MnO4﹣+5H2C2O4+6H+=10CO2+2Mn2++8H2O可知1.08g样品中含有草酸的物质的量为:0.004mol×
=0.004mol,根据反应2MnO4﹣+5H2C2O4+6H+=10CO2+2Mn2++8H2O可知1.08g样品中含有草酸的物质的量为:0.004mol×![]() =0.01mol,草酸的质量为:90g/mol×0.01mol=0.9g,含有结晶水的物质的量为:
=0.01mol,草酸的质量为:90g/mol×0.01mol=0.9g,含有结晶水的物质的量为:![]() =0.01mol,则该草酸晶体中x=
=0.01mol,则该草酸晶体中x=![]() =1,故答案为1。
=1,故答案为1。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
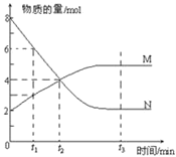
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
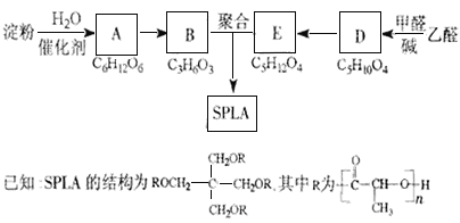
(1)淀粉是____________糖(填“单”或“多”);A的名称是_______。
(2)乙醛由不饱和烃制备的方法之一是_______________________(用化学方程式表示,可多步)。
(3)D![]() E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
E的化学反应类型属于_________反应;D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是______;D与银氨溶液反应的化学方程式为____________________________。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2反应,且1mol G与足量Na反应生成1mol H2,则G的结构简式为______。
(5)B有多种脱水产物,其中两种产物的结构简式为______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种抗心肌缺血药物的中间体,可以通过以下方法合成:
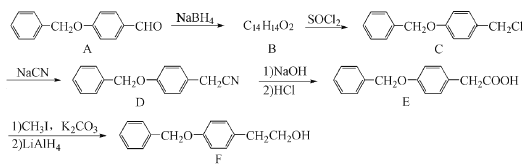
(1)化合物A中的含氧官能团为_________和___________(填官能团的名称)。
(2)化合物B的结构简式为________;由C→D的反应类型是:_______。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_________。
Ⅰ.分子含有2个苯环 Ⅱ.分子中含有3种不同化学环境的氢
(4)已知:![]() ,请写出以
,请写出以![]() 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图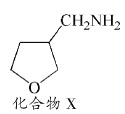 )的合成路线流程图(无机试剂可任选)_________。合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)_________。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象或结论不正确是( )
选项 | 实验步骤 | 现象 | 结论 |
A | 往酸性高锰酸钾溶液中滴加草酸溶液 | 溶液褪色 | 草酸具有还原性 |
B | 往Na2CrO4溶液中滴加过量浓硫酸 | 溶液由黄色转化为橙黄色 | CrO42-在酸性条件下完全转为Cr2O72- |
C | 装有NO2的烧瓶泡在热水中 | 烧瓶红棕色变深 | 升高温度,平衡2NO2 |
D | 往Na2S2O3溶液中滴加稀硫酸 | 有淡黄色沉淀生成 | S2O32-与H+不能共存 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基香兰素是一种合成香料,其结构简式如图:

(1)以下推测正确的是___;
a.从分子结构上看,它属于芳香烃
b.该物质能与FeCl3溶液发生显色反应
c.该物质能与碳酸钠溶液反应产生CO2气体
d.一定条件下,1mol该物质最多能与4molH2发生加成反应
(2)R物质是乙基香兰素的同分异构体,性质如下:
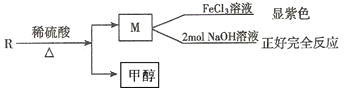
试写出任意一种符合上述条件的R的同分异构体的结构简式__________。
(3)X也是乙基香兰素的同分异构体,其可以发生如下反应:
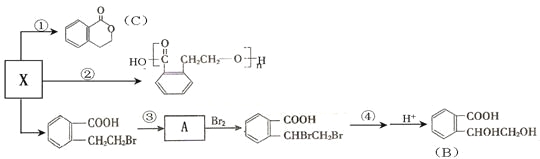
(Ⅰ)X的结构简式______________;B中含氧官能团的名称________________;
(Ⅱ)反应①的反应类型___________、化合物C的分子式为__________;
(Ⅲ)反应④的试剂是NaOH的水溶液;反应④的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究钠与CO2的反应,利用如图装置进行实验。(已知PdCl2能被CO还原为黑色的Pd)
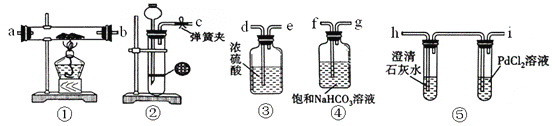
(1)装置②中用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是_______。
A. H2SO4溶液 B. CCl4 C. 苯 D. 稀硝酸
(2)请将图中各装置按顺序连接(填装置接口字母):c接______,______接____,____接______,____接____。
(3)装置④的作用是__________。
(4)检查完装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到_________时再点燃酒精灯。
(5)若反应过程中CO2足量,钠与CO2充分反应后,生成的固体物质可能有多种情况,该同学提出以下猜想:
①生成的固体物质为Na2CO3
②生成的固体物质为Ns2CO3和C的混合物
③生成的固体物质为Ns2CO3和Na2O的混合物
④生成的固体物质为Ns2O和C的混合物
假如反应过程中有下列两种情况:
I. 观察到装置⑤PdCl2溶液中有黑色沉淀,若装置①中固体成分只有一种,且向固体中加入稀盐酸可产生能使澄清石灰水变浑浊的气体,写出该情况下钠与CO2反应的化学方程式____。
II. 装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入足量的稀盐酸中产生224ml(标准状况)CO2气体,溶液中残留固体的质量为___________。
(6)设计实验方案证明装置①中加入的金属钠部分被氧化____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
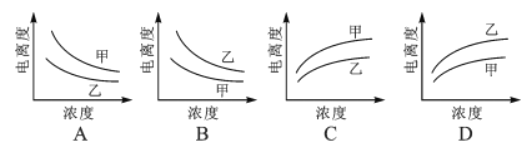
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com