

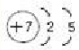 ,故答案为:
,故答案为: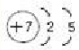 ;
;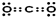 ,③和⑥可形成NaCl,用电子式表示形成其过程为
,③和⑥可形成NaCl,用电子式表示形成其过程为 ,
,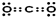 ;
; ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、高吸水性树脂属于功能高分子材料 |
| B、SiC、Al2O3的熔点很高,可用作高温结构陶瓷 |
| C、光导纤维、合成纤维和人造纤维都是有机高分子化合物 |
| D、合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
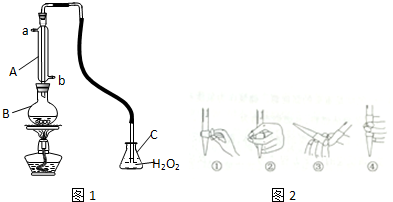
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | F | Ne | |||||
| 3 | Na | Mg | Al | Si | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
(一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:| 验序号 | 时间/min 浓度/mol?L-1 温度/℃ |
0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 | |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
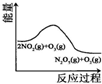 | 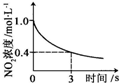 | 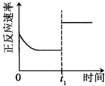 | 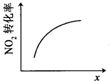 |
| 升高温度,平衡常数减小 | 0-3s内,反应速率为:v(NO2)=0.2 mol?L-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com