
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
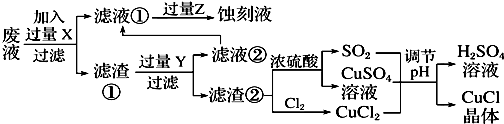
分析 要利用制作印刷电路的废液制备氯化亚铜,首先应制备并分离出铜,向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜.
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(3)依据图示可知:铜与浓硫酸反应生成硫酸铜、二氧化硫的物质的量之比为1:1,而产生CuCl的化学方程式中硫酸铜、二氧化硫物质的量之比恰好为1:1;
(4)依据氯化亚铜具有还原性,易被氧化而变质,具有见光分解的性质解答;
(5)依据图表CuCl产率可知PH=2产率最大,当pH较大时CuCl产率变低,Cu2+水解程度增大,生成的氯化亚铜少;
(6)依据方程式中各反应物量之间的关系计算CuCl的纯度,CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,CuCl~Ce4+,所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去.
解答 解:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜.
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;
故答案为:Fe;HCl;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒其方程式为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(3)依据图示可知:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体;
故答案为:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体;
(4)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
故答案为:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
(5)依据图表CuCl产率可知pH=2产率最大为90%,当pH较大时CuCl产率变低,Cu2+水解程度增大,生成的氯化亚铜少;
故答案为:2;pH较大时,Cu2+水解程度增大,反应生成CuCl减少,产率减小;
(6)根据题目中所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去,滴定0.25g样品消耗硫酸铈标准溶液的平均体积=$\frac{24.05+23.95}{2}$=24mL,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,
CuCl~Ce4+,
CuCl的纯度=$\frac{24×10{\;}^{-3}L×0.1mol/L×99.5g/mol}{0.25g}$×100%=95.5%,
故答案为:95.5%.
点评 本题为工艺流程题,为高考热点和难点,设计物质的分离、物质的制备,明确物质的性质是解题关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 、
、
| A. | ①②③⑤④ | B. | ③⑤④①② | C. | ④②①⑤③ | D. | ③④②①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
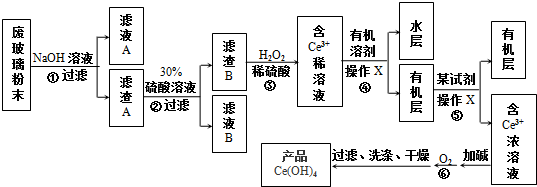
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,丁香油酚不应具有的化学性质是( )
,丁香油酚不应具有的化学性质是( )| A. | 可以发生加聚反应 | B. | 可以与强碱溶液反应 | ||
| C. | 与NaHCO3反应放出CO2 | D. | 可与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).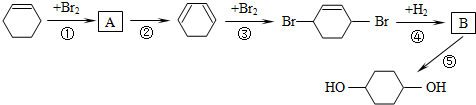
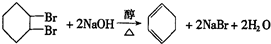
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com