
 所以“低碳经济”正成为科学家研究的主要课题.
所以“低碳经济”正成为科学家研究的主要课题.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| ||
| 6min |
| 1.6mol |
| 4mol |
| 0.4mol |
| 0.4mol |
| c(CO 2)c(H 2) |
| c(H2O)c(CO) |
| 0.2×0.2 |
| 0.3×0.8 |
| ①-② |
| 2 |
| -1275.6kJ?mol -1-(-566.0kJ?mol -1) |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、在涂料中尽量用液态有机物代替水作溶剂以减少环境污染 |
| B、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 |
| C、石油分馏可获得乙烯、丙烯和丁二烯 |
| D、新型无机非金属材料Si3N4、Al2O3可以用于制作高温结构陶瓷制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.50mol |
| B、0.19mol |
| C、0.25mol |
| D、0.31mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前2s以N2O4的浓度变化表示的反应速率为0.01mol/(L?s) |
| B、在2s时体系内的压强为开始时的1.1倍 |
| C、在平衡时体系内含N2O4 0.25mol |
| D、平衡时,N2O4的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
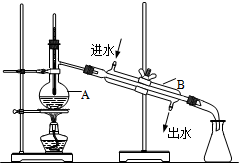 如图为实验室制取自来水的装置示意图,根据图示回答下列问题.
如图为实验室制取自来水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
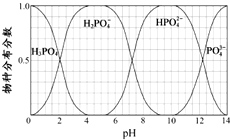 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com