
| Kw |
| 10-5 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 3 |
| 5 |
| A、0.74 mol/L |
| B、0.045 m ol/L |
| C、0.037 mol/L |
| D、0.025 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
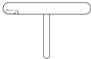 人们常用如右图所示仪器反复进行某物质的性质实验,如碘的升华实验.用该仪器能反复进行的还有:( )
人们常用如右图所示仪器反复进行某物质的性质实验,如碘的升华实验.用该仪器能反复进行的还有:( )| A、②④ | B、①③ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
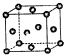 已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为:1S22S22P63S23P63d9.
已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为:1S22S22P63S23P63d9.查看答案和解析>>
科目:高中化学 来源: 题型:
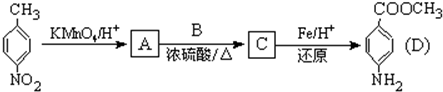
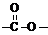 结构的基团的C的所有同分异构体的结构简式:
结构的基团的C的所有同分异构体的结构简式: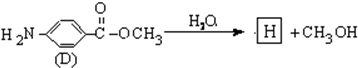
查看答案和解析>>
科目:高中化学 来源: 题型:
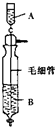 《Inorganic Syntheses》(无机合成)一书中,有一如图所示的装置,用以制备某种干燥的纯净气体.该装置中所装的药品正确的是( )
《Inorganic Syntheses》(无机合成)一书中,有一如图所示的装置,用以制备某种干燥的纯净气体.该装置中所装的药品正确的是( )| A、A中装浓盐酸,B中装浓硫酸 |
| B、A中装浓硫酸,B中装浓盐酸 |
| C、A中装氢氧化钠浓溶液,B中装浓氨水 |
| D、A中装浓氨水,B中装氢氧化钠浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
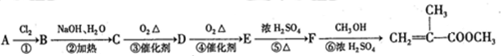 ,
,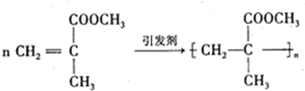
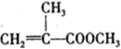 是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是
是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是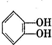 、④
、④
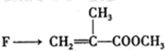
查看答案和解析>>
科目:高中化学 来源: 题型:
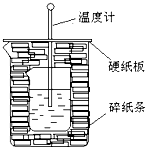 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com