
| A. | C2H4和C3H6 | B. | C2H6和C4H10 | C. | CH2O2和C2H4O2 | D. | C2H2和C6H6 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物.
解答 解:A、C2H4为乙烯,C3H6可以是丙烯,也可以是环丙烷,两者不一定是同系物,故A错误;
B、C2H6和C4H10均为饱和烷烃,符合通式CnH2n+2,故两者属于同系物,故B正确;
C、CH2O2为甲酸,C2H4O2可以为乙酸,也可以为甲酸甲酯,两者不一定是同系物,故C错误;
D、C2H2为乙炔,C6H6可以为苯,也可以为含有多个双键或三键的不饱和烃,两者不是同系物,故D错误,故选B.
点评 本题主要考查的是同系物的判断,注意同系物分子式不同,结构相似,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| C. | 聚合物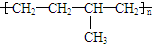 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| D. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池是新型的绿色环保电池 | |
| B. | 当电路中转移0.2mol电子时,消耗的H2SO4为0.2 mol | |
| C. | 铅蓄电池放电时负极质量减小,正极质量增加 | |
| D. | 铅蓄电池放电时电子由负极经过溶液定向移动到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于它的叙述正确的是( )
,关于它的叙述正确的是( )| A. | 维生素A1是一种易溶于水的醇 | |
| B. | 维生素A1分子中含有苯环结构 | |
| C. | 维生素A1能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,且原理相同 | |
| D. | 1mol维生素A1在催化剂作用下,最多与5molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 2:3:6 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| B. | 达到化学平衡时,N2完全转化为NH3 | |
| C. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 | |
| D. | 单位时间内消耗amolN2同时消耗2amolNH3,说明该反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
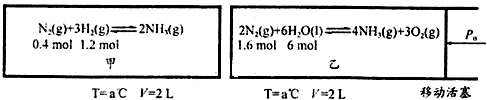
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com