

分析 (1)根据非金属性越强电负性越强来判断;元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越易电子其第一电离能越小;同周期从左到右原子半径依次减小;
(2)根据△H=反应物键能之和-生成物键能之和计算;
(3)N≡N中含有2个π键,1个σ键,根据已知数据计算判断;
(4)根据晶胞中原子数目计算结合摩尔质量,计算晶胞质量,再根据密度定义计算晶胞的体积,求边长;
(5)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,然后求出比值.
解答 解:(1)根据非金属性越强电负性越强,周期表中非金属性最强的为F,所以F的电负性最大;元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越易电子其第一电离能越小,短周期中Na原子最易失去1个电子,所以Na的第一电离能最小,Na的电子排布式为1s22s22p63s1;同周期从左到右原子半径依次减小,所以第三周期原子半径最小的元素为Cl,其价电子排布式为3s23p5;
故答案为:F;1s22s22p63s1;3s23p5;
(2)根据晶体结构可知,在晶体硅中每个硅原子实际占有2个Si-Si键,在二氧化硅中每个硅原子占有4个Si-O键,所以△H=反应物键能之和-生成物键能之和可得,△H=(175×2+498-4×460)KJ/mol=-992KJ/mol;
故答案为:-992KJ/mol;
(3)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为$\frac{942-247}{2}$kJ/mol=347.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定,
故答案为:π;
(4)晶胞的堆积棋型为简单立方堆积,则晶胞中含有1个原子,故晶胞质量为$\frac{209}{{N}_{A}}$g,晶胞的体积为V=a3cm3,故晶胞密度ρ=$\frac{m}{V}$=$\frac{\frac{209}{{N}_{A}}g}{{a}^{3}c{m}^{3}}$,解得a=$\root{3}{\frac{209}{ρ{N}_{A}}}$cm=$\root{3}{\frac{209}{ρ{N}_{A}}}$×1010pm,
故答案为:$\root{3}{\frac{209}{ρ{N}_{A}}}$×1010;
(5)与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则$\frac{m}{n}$=$\frac{12}{4}$=3;
故答案为:3.
点评 本题考查了电负性、化学键的稳定性判断以及晶胞的计算等知识点,注意根据均摊法计算晶胞中原子数目,计算晶胞的棱长是计算的关键,题目难度中等,侧重于考查学生的分析能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
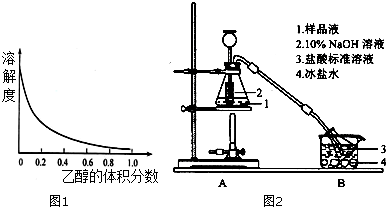
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
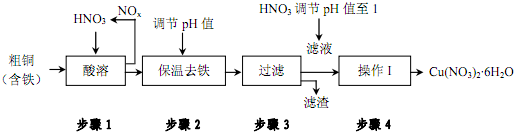
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 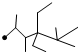 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为 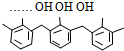 …的高聚物,其单体是甲醛和苯酚 …的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
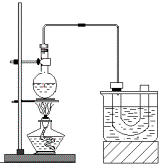 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
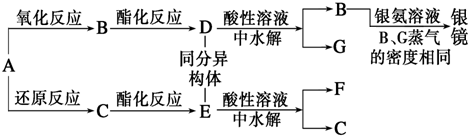
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com