
| A. | C3H8 | B. | C2H6 | C. | CH4 | D. | C4H8 |
科目:高中化学 来源: 题型:选择题
 已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )| A. | n(CH4)/n(N2)越小,CH4的转化率越高 | |
| B. | n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 | |
| C. | b点对应的平衡常数与a点一样 | |
| D. | a点对应的NH3的体积分数约为26% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
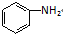 )、水杨酸(
)、水杨酸(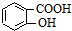 )、硝基苯与苯酚四种有机物的乙醚溶液,按如下流程利用物质的酸碱性依次分离,假设每一步分离都是完全的.(已知苯胺是一种难溶于水,具有弱碱性的有机物.)
)、硝基苯与苯酚四种有机物的乙醚溶液,按如下流程利用物质的酸碱性依次分离,假设每一步分离都是完全的.(已知苯胺是一种难溶于水,具有弱碱性的有机物.)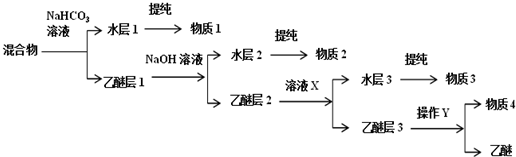
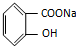 ,物质3的分子式为C6H7N.
,物质3的分子式为C6H7N. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式KAlSO4•12H2O | ||
| C. | CaCl2的电子式: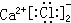 | D. | 氯化钠的电子式Na:$\underset{\stackrel{..}{Cl}}{..}$: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 非金属性:F>O>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液中:Na+,H+,NO3- | B. | 碘化钾溶液中:H+,H2O,SO32- | ||
| C. | 偏铝酸钠溶液中:K+,Cl-,SO42- | D. | 氢氧化钙溶液中:Na+,ClO-,HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
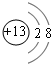 .
.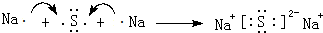 .
.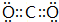 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com