
(10分)如右图所示,常温下电解5 min后,铜电极质量增加2.16g。
试回答: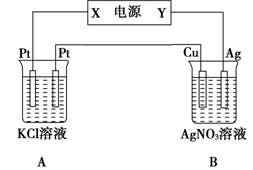
(1)电源电极X名称为_______(填“正极”或“负极”)。
(2)电解池B中阴极的电极反应式是__________。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
pH=_________(忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解完完全相同,应加入的物质是__________。
(4)已知在l0lkPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,则CH4完全燃烧的热化学方程式为__________。
(1)负极 ,(2)Ag++e-=== Ag (3)13,HCl
(4) CH4(g)+O2(g)=== CO2(g)+2H2O(l) △H =" -" 891.45kJ/mol
解析试题分析:(1)由铜电极的质量增加,发生Ag++e-=Ag,则Cu电极为阴极,可知X为电源的负极,Y为电源正极;(2)B中阴极反应为Ag++e-=Ag;(3)由A中发生2KCl+2H2O 2KOH+;依据上述计算可知电路中转移电子0.02mol,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化则c(OH-)=0.02mol/0.2L=0.1mol?L-1,c(H+)=10-13mol/L,pH=13;因为有H2和Cl2析出,故应加入HCl可使之恢复原状态。(4)2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,故1mol CH4放出的热量为891.45kJ,所以CH4完全燃烧的热化学方程式为CH4(g)+O2(g)=== CO2(g)+2H2O(l) △H =" -" 891.45kJ/mol。
2KOH+;依据上述计算可知电路中转移电子0.02mol,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化则c(OH-)=0.02mol/0.2L=0.1mol?L-1,c(H+)=10-13mol/L,pH=13;因为有H2和Cl2析出,故应加入HCl可使之恢复原状态。(4)2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,故1mol CH4放出的热量为891.45kJ,所以CH4完全燃烧的热化学方程式为CH4(g)+O2(g)=== CO2(g)+2H2O(l) △H =" -" 891.45kJ/mol。
考点:考查电解原理、热化学方程式等相关知识。


科目:高中化学 来源: 题型:填空题
(7分)某同学模拟工业“折点加氯法”处理氨氮废水的原理,进行如下研究。
| 装置(气密性良好,试剂已添加) | 操作 | 现象 |
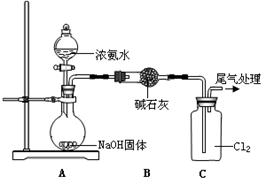 | 打开分液漏斗活塞,逐滴加入浓氨水 | ⅰ.C中气体颜色变浅 ⅱ.稍后,C中出现白烟并逐渐增多 |
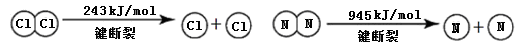
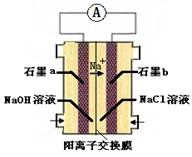
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据题意回答下列问题
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 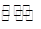 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:稀溶液中,强酸与强碱反应中和热的数值为57.3kJ/mol。
(1)用0.1molBa(OH)2配成的稀溶液跟足量的稀硝酸反应,放出______kJ的热量
(2)1L0.1mol/LNaOH溶液分别与①醋酸溶液②浓硫酸③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ),则它们由大到小的顺序是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知1molCaCO3分解需要吸收178kJ 热量,1mol焦炭完全燃烧放出393.5kJ ,试回答下列问题
(1)写出碳酸钙分解的热化学反应方程式
(2)试计算如果0.5t CaCO3煅烧成CaO(s),在理论上要用焦炭多少千克。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
C6 H5- CH2 CH3 (g) C6 H5- CH=CH2 (g) +H2(g) ΔH1
C6 H5- CH=CH2 (g) +H2(g) ΔH1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示: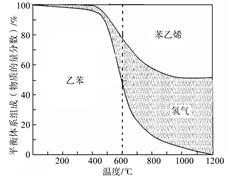
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
① 氢气的物质的量分数为 ;乙苯的物质的量分数为 ;
② 乙苯的平衡转化率为 ;
③ 计算此温度下该反应的平衡常数(请写出计算过程)。
(2) 分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(4)已知:
3C2 H2 (g)  C6 H6 (g) ΔH2
C6 H6 (g) ΔH2
C6 H6 (g) + C2H4 (g)  C6 H5- CH2CH3 (g) ΔH3
C6 H5- CH2CH3 (g) ΔH3
则反应3C2H2 (g)+ C2H4 (g)  C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com