
镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是
A.电池总反应为Mg+H2O2 = Mg(OH)2
B.正极发生的电极反应为H2O2+2H++2e- = 2H2O
C.工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
下列符合化学实验“绿色化”的有( )
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 ②在铜与浓硫酸反应的实验中,将铜片改为可调节高度的铜丝 ③将实验室的废酸与废碱中和后再排放
A.①② B.①③
C.②③ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是
A.已知C(石墨, s)=C(金刚石, s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 ;C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH= -483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电伴随化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④ B.③④ C.③④⑤ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是____ ______________(用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______________________。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于________(已知Ksp[Cu(OH)2]=2.0×10-20)。
(3)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈________性。在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO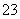 水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是( )。
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入5mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则
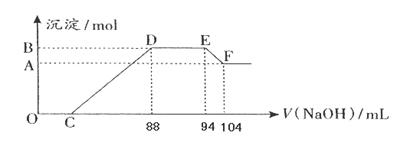
(1)B与A的差值为: mol
(2)原硝酸溶液中含硝酸的物质的量为: mol。
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为:
(4)写出铝与该浓度硝酸反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。

请回答下列问题:
(1)H的电子式是________________,其中含有的化学键类型是___________
_________________。
(2)写出反应④的现象:_______________________________________________________________________________________,
有关反应的化学方程式为_______________________________________________________________________。
(3)已知I的燃烧热是-285.8 kJ·mol-1,则1 m3(标准状况)I完全燃烧,恢复至室温时放出的热量是________(计算结果保留3位有效数字)。
(4)25 ℃时,以Pt为电极电解含有少 量酚酞的F的饱和溶液,则在________(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2 g气体,则此时溶液的pH是________(假设溶液的体积为2 L且不考虑电解后溶液体积的变化)。
量酚酞的F的饱和溶液,则在________(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2 g气体,则此时溶液的pH是________(假设溶液的体积为2 L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N,写出该反应的离子方程式:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com