
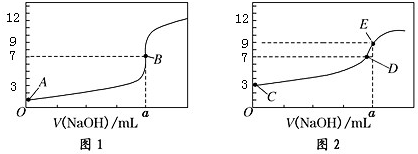
| A. | 图 1 是滴定 CH3COOH 溶液的曲线 | |
| B. | 图 2 若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点 D 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果 C、E 两点对应的 pH 分别为 3、9,则水电离的氢离子浓度之比为 1:100 |
分析 A.PH=-lgC(H+),根据酸溶液的初始pH确定盐酸滴定曲线,图1中0.1000mol/L酸的pH=1,而CH3COOH 为弱酸,0.1000mol/L的CH3COOH 的pH一定>1;
B.用氢氧化钠滴定CH3COOH,滴定终点时溶液由橙色变为黄色;
C.D点溶液为中性,则c(Na+)=c(CH3COO-)、c(OH-)=c(H+);
D.酸、碱溶液抑制了水的电离,C点中的氢氧根离子、E点中的氢离子是水电离的,据此结合溶液的pH计算出水电离的氢离子浓度之比.
解答 解:A.如果酸为强酸,则0.1000mol/L酸的pH═-lgC(H+)=1,根据图1酸的初始pH=1知,说明该酸在溶液中完全电离,为强电解质,为盐酸滴定曲线,而CH3COOH 为弱酸,0.1000mol/L的CH3COOH 的pH一定>1,为图2,故A错误;
B.图2为氢氧化钠溶液滴定CH3COOH,甲基橙变色范围为3.1-4.4,颜色为红、橙、黄,当滴定终点时溶液颜色应该由橙色变为黄色,故B错误;
C.根据图示可知,D点为中性,则c(OH-)=c(H+),结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-);可知:c(Na+)=c(CH3COO-),所以溶液中正确的离子浓度大小为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故C错误;
D.C点为酸溶液,pH=3的CH3COOH 中,氢离子抑制了水的电离,溶液中氢氧根离子是水电离的,则水电离的氢离子浓度为10-11mol/L,E点为碱性溶液,NaOH过量,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,则水电离的氢离子浓度为10-9mol/L,故C、E两点水电离的氢离子浓度之比为:10-11mol/L:10-9mol/L=1:100,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度定性比较等知识,题目难度中等,注意掌握酸碱混合的定性判断方法,明确溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解原理判断溶液中各离子浓度大小.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3NO2+H2═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
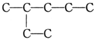
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
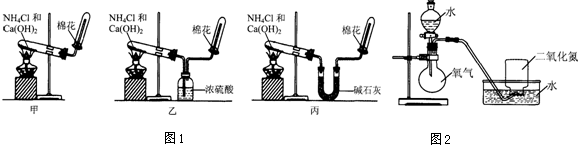
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为0.04mol/L. | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | (11) | (12) | (13) | ||||
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
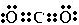 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C3H8中碳原子都采用的是sp3杂化 | |
| B. | O2、CO2、N2都是非极性分子 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO | |
| D. | CO的一种等电子体为NO+,它的电子式为+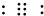 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化镁的电子式: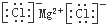 | B. | 乙醇的分子式是C2H6O | ||
| C. | 乙烯的结构简式为CH2CH2 | D. | 钾的原子结构示意图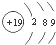 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com