
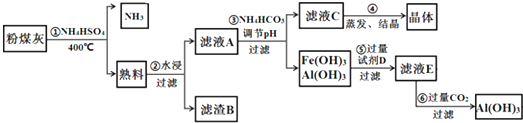
分析 粉煤灰中含有SiO2、Al2O3、Fe2O3等,加入硫酸氢铵加热反应,得到熟料中含有可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,用水浸后,滤液A中含有NH4Fe(SO4)2、NH4Al(SO4)2,滤渣B为SiO2,在滤液A中加入碳酸氢铵调节pH可生成Fe(OH)3、Al(OH)3沉淀,滤液C含有(NH4)2SO4,经蒸发结晶得到(NH4)2SO4晶体,Fe(OH)3、Al(OH)3沉淀加入过量氢氧化钠溶液,得到E为NaAlO2,通入二氧化碳,可生成氢氧化铝沉淀,以此解答该题,
(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2和氨气与水;在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,则还会生成氨水和氢氧化铝沉淀;
(2)SiO2不溶于一般酸性溶液,不溶于氨水;SiO2与NaOH溶液反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
(3)根据KSP[Al(OH)3]=1×10-33;c(Al3+)均小于或等于1×10-9 mol•L-1可认为完全沉淀,此时c(OH-)=$\root{3}{\frac{1×1{0}^{-33}}{1×1{0}^{-9}}}$=1×10-8;在酸性溶液中,H++HCO3-=H2O+CO2↑;
(4)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;第⑤步所加试剂NaOH,生成四羟基合硫酸根离子,第⑥步生成Al(OH)3的离子方程式为通入CO2,酸碱中和生成(NH4)2SO4.
解答 解:(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2和氨气与水;在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,则还会生成氨水和氢氧化铝沉淀,反应的离子方程式为2Ba2++4OH-+NH4++Al3++2SO42-=2BaSO4↓+NH3•H2O+Al(OH)3↓,
故答案为:Fe2O3+4NH4HSO4$\frac{\underline{\;400℃\;}}{\;}$2 NH4Fe(SO4)2+2NH3↑+3H2O;2Ba2++4OH-+NH4++Al3++2SO42-=2BaSO4↓+NH3•H2O+Al(OH)3↓;
(2)SiO2不溶于一般酸性溶液,不溶于氨水;SiO2与NaOH溶液反应的离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2、SiO2+2OH-=SiO32-+H2O;
(3)根据KSP[Al(OH)3]=1×10-33;c(Al3+)均小于或等于1×10-9 mol•L-1可认为完全沉淀,c(OH-)=$\root{3}{\frac{1×1{0}^{-33}}{1×1{0}^{-9}}}$=1×10-8;在酸性溶液中发生H++HCO3-=H2O+CO2↑,
故答案为:6;H++HCO3-=H2O+CO2↑;
(4)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;第⑤步所加试剂NaOH,生成四羟基合硫酸根离子,第⑥步生成Al(OH)3的离子方程式为通入CO2,酸碱中和生成(NH4)2SO4,
故答案为:玻璃棒;蒸发皿;(NH4)2SO4;NaOH溶液;[Al(OH)4]-+CO2+H2O=Al(OH)3↓+HCO3-.
点评 本题考查了物质制备实验工厂分析判断,物质性质的理解应用,离子方程式、化学方程式书写方法,盐类水解分析应用,掌握基础是关键,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{16(b+a)}{b-a}$ | B. | $\frac{16(b-a)}{b+a}$ | C. | $\frac{8(b+a)}{b-a}$ | D. | $\frac{8(b-a)}{b+a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验Ⅰ:导管口气体可被点燃,产生淡蓝色火焰 | |
| B. | 实验Ⅱ:振荡后静置,溶液分层,且两层均接近无色 | |
| C. | 实验Ⅲ:试管中有气泡冒出,溶液颜色无明显变化 | |
| D. | 实验Ⅳ:试管内气体颜色逐渐变浅,试管壁出现油状液滴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀H2SO4与铜不反应,但浓H2SO4在加热条件下可与铜反应 | |
| D. | 浓硫酸不与铁、铝发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、Na、S、Cl、N | B. | H、Na、S、Br、P | C. | H、Li、O、F、N | D. | H、Mg、S、O、N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,溶液中H+向PbO2电极迁移 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g | |
| C. | 充电时,电解质溶液的pH增大 | |
| D. | 充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com