
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
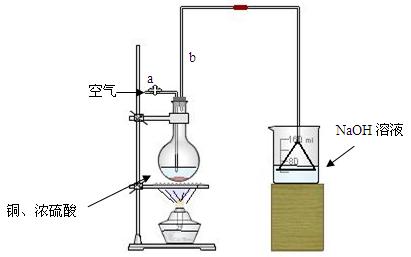
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
⑵烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(12分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
(1)烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行___ _、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是 。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因: ,
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
⑵烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
查看答案和解析>>
科目:高中化学 来源:2011届黑龙江省哈三中等四校高三第一次高考模拟联考(理综)化学部分 题型:实验题
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: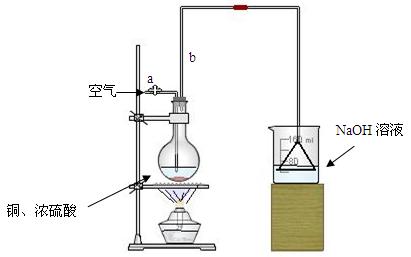
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
⑵烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省高三起点考试化学试卷 题型:实验题
(12分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
(1)烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行___ _、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是 。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因: ,
。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省等四校高三第一次高考模拟联考(理综)化学部分 题型:实验题
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
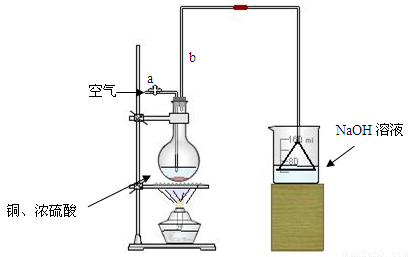
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
⑵烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com