
����Ŀ��������VSEPRģ���жϣ�������������ԭ�Ӷ���ͬһƽ���ϵ�һ���� ��
A��SO32����NO2�� B��NO3����SO3
C��H3O+��ClO3�� D��PO43����SO32��
��CaF2�ľ�����ͼ��ʾ��
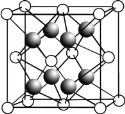
�������й�CaF2�ı�����ȷ����______________��
a��Ca2+��F��������ھ�����������
b��F�������Ӱ뾶С��Cl������CaF2���۵����CaCl2
c�����������ӱ�Ϊ2:1�����ӻ��������CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��CaF2������ˮ���������ں�Al3+����Һ����ԭ����________________________ (�����ӷ���ʽ��ʾ����֪[AlF6]3������Һ�п��ȶ�����)��
��������F������λ����_________����һ��Ca2+�Ⱦ����������Ca2+��_______����
��ͭ��п����Ԫ�صĵ�һ�����ܡ��ڶ������������ʾ
������/kJ��mol��1 | I1 | I2 |
ͭ | 746 | 1958 |
п | 906 | 1733 |
��д��Cuԭ�Ӻ�������Ų�ʽ ��
��ͭ�ĵ�һ������(I1)С��п�ĵ�һ�����ܣ���ͭ�ĵڶ�������(I2)ȴ����п�ĵڶ������ܣ�����Ҫԭ���� ��
���𰸡�
��B
�Ƣ�bd����3CaF2+ Al3+=[AlF6]3��+3Ca2+����4 ��12
����[Ar]3d104s1
��Cuԭ��ʧȥһ�����Ӻ�������Ų�Ϊ[Ar]3d10����пΪ[Ar]3d104s1�����ݺ��ع���ͭ�ﵽ�˽��ȶ�״̬������Cu�ĵڶ���������Խϴ�
��������
����������� A��SO32-����ԭ�ӵļ۲���Ӷ���=3+![]() (6+2-2��3)=4���йµ��Ӷԣ��ռ乹��Ϊ�����Σ�NO2-����ԭ�ӵļ۲���Ӷ���=2+
(6+2-2��3)=4���йµ��Ӷԣ��ռ乹��Ϊ�����Σ�NO2-����ԭ�ӵļ۲���Ӷ���=2+![]() (5+1-2��2)=3������һ���µ��Ӷԣ��ռ乹��ΪV�Σ���A��ѡ��B��NO3-����ԭ�ӵļ۲���Ӷ���=3+
(5+1-2��2)=3������һ���µ��Ӷԣ��ռ乹��ΪV�Σ���A��ѡ��B��NO3-����ԭ�ӵļ۲���Ӷ���=3+![]() (5+1-3��2)=3��û�йµ��Ӷԣ��ռ乹��Ϊƽ�������Σ�SO3����ԭ�ӵļ۲���Ӷ���=3+
(5+1-3��2)=3��û�йµ��Ӷԣ��ռ乹��Ϊƽ�������Σ�SO3����ԭ�ӵļ۲���Ӷ���=3+![]() (6-2��3)=3��û�йµ��Ӷԣ��ռ乹��Ϊƽ�������Σ���Bѡ��C��H3O+����ԭ�ӵļ۲���Ӷ���=3+
(6-2��3)=3��û�йµ��Ӷԣ��ռ乹��Ϊƽ�������Σ���Bѡ��C��H3O+����ԭ�ӵļ۲���Ӷ���=3+![]() (6-1-3��1)=4������һ���µ��Ӷԣ��ռ乹��Ϊ�����Σ�ClO3-����ԭ�ӵļ۲���Ӷ���=3+
(6-1-3��1)=4������һ���µ��Ӷԣ��ռ乹��Ϊ�����Σ�ClO3-����ԭ�ӵļ۲���Ӷ���=3+![]() (7+1-3��2)=4������һ���µ��Ӷԣ��ռ乹��Ϊ�����Σ���C��ѡ��D��PO43-����ԭ�ӵļ۲���Ӷ���=4+
(7+1-3��2)=4������һ���µ��Ӷԣ��ռ乹��Ϊ�����Σ���C��ѡ��D��PO43-����ԭ�ӵļ۲���Ӷ���=4+![]() (5+3-4��2)=4��û�йµ��Ӷԣ��ռ乹��Ϊ�������壬SO32-����ԭ�ӵļ۲���Ӷ���=3+
(5+3-4��2)=4��û�йµ��Ӷԣ��ռ乹��Ϊ�������壬SO32-����ԭ�ӵļ۲���Ӷ���=3+![]() (6+2-2��3)=4���йµ��Ӷԣ��ռ乹��Ϊ����������D��ѡ����ѡB��
(6+2-2��3)=4���йµ��Ӷԣ��ռ乹��Ϊ����������D��ѡ����ѡB��
����a���������Ӽ���ھ��������;��������Ca2+��F-����ھ����������ã������ھ����������a����b�����Ӿ�����۵�������������ɡ����Ӱ뾶�йأ����Ӱ뾶ԽС�����Ӿ�����۵�Խ�ߣ�����CaF2���۵����CaCl2����b��ȷ��c������Ľṹ���ɱȡ��뾶���йأ��������ӱ�Ϊ2��1�����ʣ���CaF2����ĵ�ɱ���ͬ�����뾶�����ϴ����幹�Ͳ���ͬ����c����d��CaF2�еĻ�ѧ��Ϊ���Ӽ������ӻ�����������ʱ�ܷ������룬���������ƶ������ӣ��ܵ��磬���CaF2������״̬���ܵ��磬��b��ȷ���ʴ�Ϊ��bd����CaF2������ˮ���������ں�Al3+����Һ�У���Ϊ����Һ��F-��Al3+���γɺ��ѵ����������AlF63-��ʹCaF2���ܽ�ƽ�����ƣ��䷴Ӧ�����ӷ���ʽΪ��3CaF2+Al3+=3Ca2++AlF63-���ʴ�Ϊ��3CaF2+Al3+=3Ca2++AlF63-��
�����ݽṹ��֪�������а�����ĿΪ8��![]() +6��
+6��![]() =4��������ĿΪ8����˺���ΪF-��������ÿ��F����Χ��4��Ca2+���ӣ���λ����4��ͼ��CaF2������ÿ����������Ca2+��������ҵȾ����Ca2+������Ϊ3����ͨ��ÿ��Ca2+���γ�8��������ÿ��Ca2+����2�Σ�������Ca2+��������ҵȾ����Ca2+������Ϊ(8��3)��2=12�����ʴ�Ϊ��4��12��
=4��������ĿΪ8����˺���ΪF-��������ÿ��F����Χ��4��Ca2+���ӣ���λ����4��ͼ��CaF2������ÿ����������Ca2+��������ҵȾ����Ca2+������Ϊ3����ͨ��ÿ��Ca2+���γ�8��������ÿ��Ca2+����2�Σ�������Ca2+��������ҵȾ����Ca2+������Ϊ(8��3)��2=12�����ʴ�Ϊ��4��12��
����CuΪ29��Ԫ�أ�ԭ�Ӻ�������Ų�ʽΪ[Ar]3d104s1���ʴ�Ϊ��[Ar]3d104s1��
������е��Ӵ���ȫ����ȫ�ա�����ʱ���ȶ���������̬Cuʧȥһ�����ӱ�ɽṹΪ[Ar]3d10��Cu+�������ϵͣ�����Cu�ĵڶ���������Խϴ�(����̬Znʧȥһ�����ӱ�ɽṹΪ[Ar]3d104s1��Zn+������ʧȥһ�����ӣ�����Zn�ĵڶ���������Խ�С)���ʴ�Ϊ��Cuԭ��ʧȥһ�����Ӻ�������Ų�Ϊ[Ar]3d10����пΪ[Ar]3d104s1�����ݺ��ع���ͭ�ﵽ�˽��ȶ�״̬������Cu�ĵڶ���������Խϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������������������ɳ�����չ������ء�����˵������ȷ����( )
A���⻯ѧ�����ǵ��������������������������е�һЩ̼�⻯�������ú����ɵ�һ���ж�����
B����ú����������ú�ĵ��������ȼ�ϸ��칤�������ڼ�����������
C����ɫ��ѧ�ĺ�����Ӧ�û�ѧԭ���Ի�����Ⱦ��������
D������ɻ���ʹ�õĸ����մ������������̼��ά����ǿ��������ϲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ݻ��ɱ���ܱ�������ʢ��������A��B�Ļ�����壬��һ�������·�����Ӧ��A+3B![]() 2C����ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�������ݻ�ΪVL������C��������ռ10 % ,�����ƶ���ȷ����( )
2C����ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�������ݻ�ΪVL������C��������ռ10 % ,�����ƶ���ȷ����( )
��ԭ�����������Ϊ1.2L
��ԭ�����������Ϊ1.1L
����Ӧ�ﵽƽ��ʱ����A���ĵ�0.05VL
����Ӧ�ﵽƽ��ʱ����B���ĵ�0.05VL
A���ڢ� B���ڢ� C���٢� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
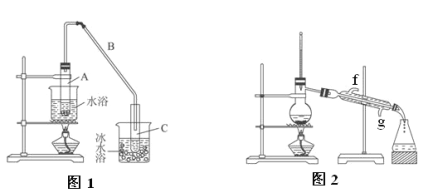
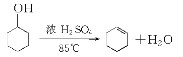
����Ŀ��ij��ѧС���������������������װ��(ͼ1�����û������Ʊ�����ϩ��
��֪��
�ܶ�(g�� cm��3�� | �۵�(���� | �е�� | �ܽ��� | |
������ | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | ��103 | 83 | ������ˮ |
��1���Ʊ���Ʒ����12.5 mL�����������Թ�A�У��ټ���1 mLŨ���ᣬҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
��A�����Ƭ��������__________________��
���Թ�C���ڱ�ˮԡ�е�Ŀ����___________________��
��2���Ʊ���Ʒ��
�ٻ���ϩ��Ʒ�к��л������������������ʵȡ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��________��(��ϡ����¡�������Һ����____________(��������ϴ�ӡ�
a��KMnO4��Һ b��ϡH2SO4 c��Na2CO3��Һ
���ٽ�����ϩ��ͼ2װ��������ȴˮ��________�ڽ��롣����ʱ������ʯ�ң�Ŀ����__________��
���ռ���Ʒʱ�����Ƶ��¶�Ӧ��__________���ң�ʵ���ƵõĻ���ϩ��Ʒ�����������۲��������ܵ�ԭ����___________����ѡ�������
a������ʱ��70����ʼ�ռ���Ʒ
b��������ʵ����������
c���Ʊ���Ʒʱ���������Ʒһ������
��3���������ֻ���ϩ��Ʒ�ʹ�Ʒ�ķ�������������____________��
a�������Ը��������Һ b���ý����� c���ⶨ�е�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС�����о�ǰ18��Ԫ��ʱ���֣����ݲ�ͬ�ı����ɣ�Ԫ�����ڱ��в�ͬ��������ʽ����������ǰ�ԭ������������˳�����У����γ�ͼ����ʾ������ţ����״��ͼ��ÿ������������һ��Ԫ�أ�����P�������Ԫ�ء�
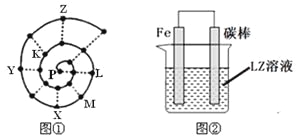
��1��XԪ���ڳ������ڱ��е�λ�� �������ں��壩��
��2��д��M��Z����Ԫ���γɵĻ�����ĵ���ʽ ��
��3������˵����ȷ����_______
a��ZԪ�ض�Ӧ���⻯���KԪ�ض�Ӧ���⻯��е��
b������������Ԫ�ش���ͬһ����
c��K��L��X����Ԫ�ص����Ӱ뾶��С˳����X3+��L +��K 2
d����K��L����Ԫ����ɵĻ������п��ܺ��й��ۼ�
��4��ͼ��װ�ÿ���ģ������ĸ�ʴ������һ���ĵ缫��Ӧʽ�� ������ͼ����Һ�еμ�������̪��Һ�����е�⣬����Fe�缫������Һ��죬д���õ��ص����ӷ���ʽ _�������������������������õ��� _ԭ������������������ԭ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɵ����ʵİ�����֮����ļ��ṹʽ�ǣ� ��
A. NH��CO B. ��NH��CO�� C. ��NH2��COOH�� D. NH2��COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
�� SO2��2H2O��I2===H2SO4��2HI
�� 2HI![]() H2��I2
H2��I2
�� 2H2SO4===2SO2��O2��2H2O
��1������������Ӧ�������ж���ȷ����____________��
a����Ӧ�����ڳ����½��� b����Ӧ����SO2�����Ա�HIǿ
c��ѭ���������貹��H2O d��ѭ�����̲���1 mol O2��ͬʱ����1 mol H2
��2��һ���¶��£���1 L�ܱ������м���1 mol HI(g)��������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��

0��2 min�ڵ�ƽ����Ӧ����v(HI)��____________�����¶��£�H2(g)��I2(g)![]() 2HI(g)��ƽ�ⳣ��K��____________��
2HI(g)��ƽ�ⳣ��K��____________��
��3��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ��____________�ƶ�(����������ҡ�����)�����������������Լ��е�____________������H2�����ʽ�����
a��NaNO3 b��CuSO4 c��Na2SO4 d��NaHSO3
��4����H2Ϊȼ�Ͽ���������ȼ�ϵ�ء�
��֪2H2(g)��O2(g)===2H2O(l) ��H����572 kJ��mol��1
ij����ȼ�ϵ���ͷ�228.8 kJ����ʱ������1 molҺ̬ˮ���õ�ص�����ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Իش����и��⣺
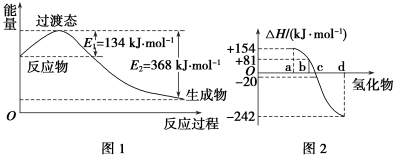
��1����ͼ1��ʾ��NO2��CO��Ӧ����CO2��NO�����������仯��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��____________________��
��2����ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йء�
����֪��H2(g)��Cl2(g)===2HCl(g) ��H����185 kJ��mol��1
����գ�
���ۼ� | H��H | Cl��Cl | H��Cl |
����/(kJ��mol��1) | 436 | 247 | ________ |
��ͼ2�б�ʾ����Ԫ���������������������⻯��ʱ���ʱ����ݣ������ʱ����ݿ�ȷ��a��b��c��d�ֱ��������Ԫ�أ���д�����ֽⷴӦ���Ȼ�ѧ����ʽ��_______________________��
��3����֪��Fe2O3(s)��3CO(g)===2Fe(s)��3CO2(g) ��H����25 kJ��mol��1��
3Fe2O3(s)��CO(g)===2Fe3O4(s)��CO2(g) ��H����47 kJ��mol��1��
Fe3O4(s)��CO(g)===3FeO(s)��CO2(g) ��H����19 kJ��mol��1��
��д��CO��ԭFeO���Ȼ�ѧ����ʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ŨH2SO4�������У���ȷ����( )
A��ŨH2SO4��ͭƬ���ȵķ�Ӧ�У�ŨH2SO4�ȱ��ֳ�ǿ�����ԣ��ֱ��ֳ�����
B��ŨH2SO4��������˳���������Ľ�����Ӧ���ɵ�����һ��ΪH2
C�������£�����������ŨH2SO4��Ӧ�����Կ����������Ƶ���������ŨH2SO4
D��ŨH2SO4�Dz��ӷ���ǿ�ᣬ�������ǻӷ������ᣬ���Կ���ŨH2SO4��FeS��Ӧ��ȡH2S����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com