
| A. | ①②③ | B. | ③④⑤ | C. | ①②④ | D. | ①③⑤⑥ |
分析 ①根据分散质微粒的大小可以将混合物进行分类;
②一氧化碳、二氧化碳、碳酸、碳酸盐性质与无机物相似,归为无机物;
③物理变化无新物质生成,化学变化生成新物质;
④根据除稀有气体和第ⅡA族外,多数主族元素既有金属元素也有非金属元素;
⑤强电解质和弱电解质的划分是看在水中是否能够完全电离;
⑥化学上把最终表现为吸收热量的化学反应叫做吸热反应,把放出热量的反应叫做放热反应.
解答 解:①根据分散质微粒直径的大小,可以将分散系分为胶体、浊液和溶液三大类,故①正确;
②有机物是指含有碳元素的化合物,例如甲烷,但是一氧化碳、二氧化碳、碳酸、碳酸盐性质与无机物相似,归为无机物,故②错误;
③物理变化无新物质生成,化学变化生成新物质,所以根据是否有新物质生成将物质变化分为物理变化和化学变化,故③正确;
④能与金属元素同主族的非金属元素有很多,它们与同主族金属元素具有相同的最外层电子数,例如氢原子最外层只有一个电子和金属钠一样,但它不是金属,所以不能根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素,故④错误;
⑤在水中能否完全电离可以将电解质分为强电解质和弱电解质,完全电离的电解质为强电解质,部分电离的电解质为弱电解质,故⑤正确;
⑥化学反应一定伴随能量的转化,根据化学反应中的热效应,将化学反应分为放热反应、吸热反应,故⑥正确;
故选D.
点评 本题考查反应的分类和物质的分类,题目难度不大,涉及分散系、放热吸热反应、元素的分类、有机物和无机物区别等知识点,注重基础知识的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3<△H2<△H1<△H4<△H5 | B. | △H1<△H2<△H3<△H5<△H4 | ||
| C. | △H4<△H5<△H1<△H2<△H3 | D. | △H4<△H5<△H3<△H2<△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3s1和3s23p4 | B. | 3s23p4 和2s22p4 | ||
| C. | 3s2和2s22p5 | D. | 2s22p2 和2s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=3的溶液中:Na+、NO3-、Cl-、Al3+ | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+ | |
| C. | 由水电离出的c(H+)=10-13 mol•L-1的溶液中:CO32-、SO42-、Cl-、Na+ | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与H2O反应产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| B. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| D. | 向明矾溶液中滴入少量氢氧化钡溶液:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
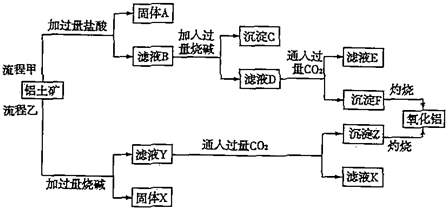
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
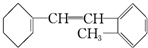 ,据此填写下列空格.
,据此填写下列空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①②③④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com