
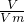 =
=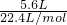 =0.25mol,只有氮气的物质的量为0.25mol时,5.6 L N2中含有n个氮分子,阿伏加德罗常数为4n,该题未指明标况,故A错误;
=0.25mol,只有氮气的物质的量为0.25mol时,5.6 L N2中含有n个氮分子,阿伏加德罗常数为4n,该题未指明标况,故A错误; =
=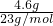 =0.2mol,100 mL含0.1 mol HCl的物质的量为0.01mol,根据2Na+2HCl=2NaCl+H2↑,钠过量,过量的钠与水反应,2Na+2H2O═2NaOH+H2↑,所以0.2mol钠能生成0.1mol的氢气,钠从0价变为上述两反应产物中的+1价钠,失去电子为0.2mol,转移电子数目为0.2NA,故B正确;
=0.2mol,100 mL含0.1 mol HCl的物质的量为0.01mol,根据2Na+2HCl=2NaCl+H2↑,钠过量,过量的钠与水反应,2Na+2H2O═2NaOH+H2↑,所以0.2mol钠能生成0.1mol的氢气,钠从0价变为上述两反应产物中的+1价钠,失去电子为0.2mol,转移电子数目为0.2NA,故B正确;

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com