
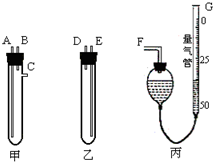
 某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:
某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:| m |
| M |
| ||
| 24 |
| 12aV |
| 5mx |
| 12aV |
| 5mx |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
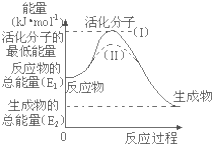 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图1,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
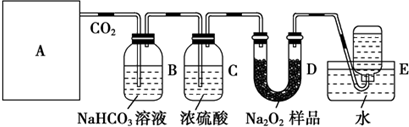
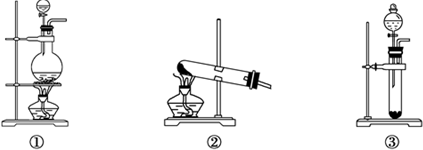
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同.
乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同. | 温度 (℃) | 乙醇转化率 (%) | 有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
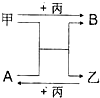 甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:
甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
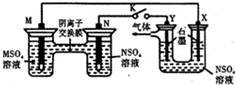 在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )| A、左装置中溶液c(M2+)减小 |
| B、N和X的电极反应式均为:N2++2e-=N |
| C、Y电极上有O2产生,发生还原反应 |
| D、若M电极转移了0.4mol电子,则y电极生成2.24L气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com