
【题目】(1)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:![]()
![]()
![]()
① 若在上述反应中有30 %的氧气转化为臭氧,所得混合气的平均摩尔质量为________![]() (保留一位小数)
(保留一位小数)
②将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为__________L
③实验室将氧气和臭氧的混合气体0.896L (标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气态全部参加反应),粉末的质量变为21.6g,则原混合气中臭氧的体积分数为__________,该混合气体对氢气的相对密度为_________________。
【答案】3 17:16 4:3 35.6 3 50% 20
【解析】
(1)根据物质分子中含有的O原子个数关系计算;
(2)根据n=![]() 计算;
计算;
(3)根据氨分子与甲烷分子中含有的H原子个数关系计算;
(4)①设原有O2 为1 mol,计算转化的氧气与生成的臭氧的物质的量,进而计算剩余的氧气的物质的量,根据平均摩尔质量计算;
②根据差量法计算臭氧的体积;
③先计算混合气体的物质的量,设臭氧的体积分数为a,根据氧原子守恒根据氧原子守恒解题,根据混合气体的平均相对分子质量比等于其密度比。
(1) 1.5 mol CO2中含有的氧原子的物质的量是3mol,由于H2O中含有1个O原子,所以O原子的物质的量是3mol,则H2O的物质的量也就是3mol;
(2)假如气体的物质的量都是1mol,则1molNH3质量是17g,1molCH4的质量是16g,所以等物质的量的氨气与甲烷的物质的量的比是17:16;
(3)1个NH3中含有3个H原子,1个CH4中含有4个H原子,若二者含相同数目的H原子,假如都是12mol,则NH3和CH4的物质的量之比为(12÷3):(12÷4)=4:3;
(4)①设原有O2 1 mol,发生反应的O2为1 mol×30%=0.3 mol,由反应3O2![]() 2O3知:生成的O3为0.2 mol,故反应后所得气体O3为0.2mol和O2为(1-0.3)mol=0.7 mol,因此平均摩尔质量=
2O3知:生成的O3为0.2 mol,故反应后所得气体O3为0.2mol和O2为(1-0.3)mol=0.7 mol,因此平均摩尔质量=![]() =35.6 g/mol;
=35.6 g/mol;
②由反应3O2![]() 2O3知反应消耗3体积O2,会产生2体积的O3,气体体积减少1L。现在气体体积由反应前8L变为反应后的6.5L,气体积减少8L-6.5L=1.5L,则其中含有臭氧为1.5L×2=3L;
2O3知反应消耗3体积O2,会产生2体积的O3,气体体积减少1L。现在气体体积由反应前8L变为反应后的6.5L,气体积减少8L-6.5L=1.5L,则其中含有臭氧为1.5L×2=3L;
③混合气体的物质的量n=![]() =0.04mol,设臭氧的体积分数为a,根据氧原子守恒,0.04mol×a×3+0.04mol×(1-a)×2=
=0.04mol,设臭氧的体积分数为a,根据氧原子守恒,0.04mol×a×3+0.04mol×(1-a)×2=![]() mol,解得a=50%,即其中含有O2、O3的物质的量分别是0.02mol,0.02mol,则混合气体的平均相对分子质量=
mol,解得a=50%,即其中含有O2、O3的物质的量分别是0.02mol,0.02mol,则混合气体的平均相对分子质量=![]() =40,该混合气体对氢气的相对密度为D=M(混):M(H2)=40:2=20。
=40,该混合气体对氢气的相对密度为D=M(混):M(H2)=40:2=20。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 室温下,1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
B. 25℃时,0.1mol L-1的HA溶液中![]() = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,BaSO4在水中有沉淀和溶解的平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molA和1molB,发生下列反应:2A(g)+B(g)![]() 2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
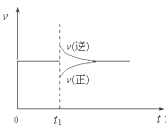
A、保持压强不变,升高反应温度
B、保持温度不变,增大容器体积
C、保持温度和容器体积不变,充入1molC(g)
D、保持温度和压强不变,充入1molC(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液以备使用,请回答下列问题。
(1)配制过程中需要使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、____。
(2)该同学应用托盘天平称取NaOH固体的质量为____g。
(3)使用容量瓶前需检查是否漏液,检查的方法是____,用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是___(填序号)。
A.干燥的
B.不漏液的
C.用欲配制的溶液润洗过的
(4)配制过程中,定容时俯视容量瓶的刻度线,则所配制溶液的浓度将___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M可用于消毒剂、抗氧化剂、医药中间体。实验室由芳香烃A制备M的一种合成路线如下:

请回答:
(1)B的化学名称为___________;D中官能团的名称为______________________。
(2)由F生成G的反应类型为___________;F的分子式为___________。
(3)由E转化为F的第一步反应的化学方程式为______________________。
(4)M的结构简式为___________。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。写出符合要求的Q的一种结构简式______________________。
(6)参照上述合成路线和信息,以苯甲酸乙酯和CH3MgBr为原料(无机试剂任选),设计制备 的合成路线_________________________________。
的合成路线_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸溶液.(用序号abc填空)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是__________.
②当其pH相同时,物质的量浓度由大到小的顺序为_________.将其稀释10倍后,pH由大到小的顺序为_____________
(2)某温度下,纯水中的c (H+)= 4.0×10-7 mol/L, 则此温度下纯水中的c (OH-)=______________mol/L; 若温度不变, 滴入稀NaOH溶液, 使c (OH-)= 5.0×10-6 mol/L,则溶液的c (H+)= _________________mol/L.
(3)在25℃时,100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合, 混合后溶液的pH= _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一化学反应,在一定温度下,反应物A的浓度从3.0 mol/L变为2.0 mol/L需要10秒,则从2.0 mol/L变为1.0 mol/L大概需要 ( )
A. 4秒B. 7秒C. 10秒D. 13秒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是

A. 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B. 0.1 mol·L-1HA的溶液中由水电离出的c(H+)=1×10-13 mol·L-1
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com