
【题目】实验室有以下几种物质:金刚石、生铁、氧化铝、氢氧化钾、醋酸、酒精.请按要求写出有关物质的化学式.
属于单质的是;属于碱的是;属于氧化物的是;属于酸的是 .
科目:高中化学 来源: 题型:
【题目】[2016海南]下列有关实验操作的叙述错误的是
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的相对分子质量与X最最高价氧化物的相对分子质量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子.试回答:
(1)写出各元素名称:X______、Y______、Z______.
(2)X离子的结构简式图为_________,X与Y形成的离子化合物的化学式为______,Z与氢形成的化合物的化学式 ______.
(3)Y单质在空气中燃烧产物与水反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
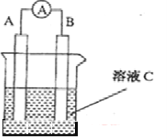
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为________________,电池总反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等温等压过程在低温下不能自发进行,而在高温下可自发进行的条件是
A. △H<0, △S<0 B. △H>0, △S<0 C. △H<0, △S>0 D. △H>0, △S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/mol·L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在1020 min内,以物质A表示的平均反应速率为______mol·L-1,50min时,v(正)_____(填“<” “>” 或“=”)v(逆)。
(2)020 min内,实验2比实验1的反应速率________(填“快”或“慢”),其原因可能是__________。
(3)实验3比实验1的反应速率____________(填“快”或“慢”),其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。据图回答下列问题:
(1)写出A、C、D的结构简式:
A__________,C____________,D____________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________(反应类型________)。
②________________________(反应类型________)。
(3)⑤反应发生时对氯气要求:_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可以发生如下反应:NaCN+HNO2=HCN+NaNO2;NaCN+HF=HCN+NaF ; NaNO2+HF=HNO2+NaF , 由此可判断下列叙述中正确的是
A. HNO2的电离平衡常数是③ B. HNO2的电离平衡常数是①
C. HCN的电离平衡常数是② D. HF的电离平衡常数是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O===O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com