
 .
.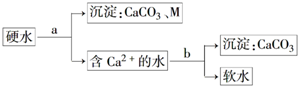
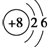
分析 (1)①氧原子核外电子层数是2,最外层电子数是6,根据原子结构示意图的画法来回答;
②依据热化学方程式结合盖斯定律计算得到;
③由阳极制得臭氧,阴极制得过氧化氢,电解总方程式为:3H2O+3O2═3H2O2+O3,电解池中阴极上氧气得到电子生成过氧化氢发生还原反应;
(2)用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,反应生成硫酸钠、二氧化碳、二氧化氯、水以此来解答;
(3)向硬水中加入氧化钙,可以将钙离子、镁离子沉淀,碳酸根离子可以将钙离子沉淀;
(4)由利用Ag++Cl-=AgCl↓计算水样中Cl-的物质的量及其浓度.
解答 解:(1)①氧原子核外电子层数是2,最外层电子数是6,氧原子结构示意图为: ,故答案为:
,故答案为: ;
;
②a、6Ag(s)+O3(g)═3Ag2O(s);△H=-235.8kJ/mol.
b、2Ag2O(s)═4Ag(s)+O2(g);△H=+62.2kJ/mol
依据盖斯定律a×2+b×3得到:2O3(g)═3O2(g);△H=-285kJ/mol;
故答案为:2O3(g)═3O2(g);△H=-285kJ/mol;
③由阳极制得臭氧,阴极制得过氧化氢.电解总方程式为:3H2O+3O2═3H2O2+O3,阳极反应为3H2O=O3+6H++6e-,阴极反应为6H++3O2+6e-=3H2O2;
故答案为:6H++3O2+6e-=3H2O2;
(2)用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,反应生成硫酸钠、二氧化碳、二氧化氯、水,方程式为:H2C2O4+2NaClO3+H2SO4═Na2SO4+2CO2↑+2ClO2↑+2H2O,
故答案为:H2C2O4+2NaClO3+H2SO4=Na2SO4+2CO2↑+2ClO2↑+2H2O;
(3)向硬水中加入氧化钙,和水反应生成氢氧化钙,氢氧化钙可以和碳酸氢根离子、镁离子之间反应,可以得到碳酸钙、氢氧化镁沉淀,再加入碳酸钠可以将剩余的碳酸根离子沉淀,发生的反应为:Ca2++CO32-=CaCO3↓,故答案为:CaO;Mg(OH)2;Ca2++CO32-=CaCO3↓;
(4)由Ag++Cl-=AgCl↓可知,n(Cl-)=12.12×0.001L×0.001000mol•L-1=12.12×10-6mol,所以水样中c(Cl-)=$\frac{12.12×1{0}^{-6}}{30×1{0}^{-3}}$mol/L=4.04×10-4 mol•L-1,
故答案为:4.04×10-4 mol•L-1.
点评 本题考查了热化学方程式和盖斯定律的计算应用、氧化还原反应及溶度积的计算,把握习题中的信息及发生的氧化还原反应、Ksp的计算为解答的关键,侧重学生分析能力及计算能力的考查,题目难度中等.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺: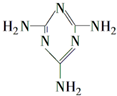 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸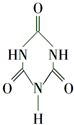 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 4:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 工业制硫酸、硝酸的关键步骤都应用了催化氧化的方法 | |
| C. | 水泥、玻璃、光导纤维都是硅酸盐产品 | |
| D. | 钠、铝、铁、硫、氯等元素在自然界中只有化合态存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com