
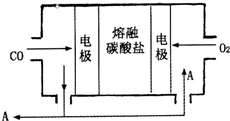
 用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.
用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2. 分析 燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;将两个方程式相加即得一氧化碳燃烧方程式;根据电极反应分析即可.
解答 解:该燃料电池的总反应为:2CO+O2=2CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为:2CO-4e-+2CO32-=4CO2,由电极反应可知电池工作时参加循环的物质为CO2,
故答案为:2CO-4e-+2CO32-=4CO2;CO2.
点评 本题考查了燃料电池的原理及其电解方程式的书写等知识点,题目难度不大,注意电解质溶液对电极反应的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 硅酸钠溶液与足量CO2反应:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2溶液中加入少量氯水2Fe2++Cl2=2Fe3++2Cl- | |
| B. | NaClO (aq) 中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①②④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 分液时,上层液体从分液漏斗下口流出 | |
| C. | 在制取蒸馏水的实验中收集冷凝水时,应弃去开始蒸馏出的部分 | |
| D. | 在制取蒸馏水的实验中,冷水从冷凝管上口入,下口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| 平行测定数据 | 平均值 | ||||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为推广氢能的使用,工业上可采用电解水法制取大量氢气 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 将某些废旧塑料熔化后再成型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com