
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 硬度由大到小:金刚石>晶体硅>碳化硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
分析 A.不含氢键的分子晶体中熔沸点与其相对分子质量成正比;
B.都是原子晶体,化学键越强,硬度越大,原子半径越小,键长越大,化学键越强;
C.金属晶体熔沸点与金属键成正比,金属键与原子半径成反比、与电荷成正比;
D.离子晶体晶格能与离子半径成反比、与电荷成正比.
解答 解:A.四种分子晶体的组成和结构相似,分子的相对分子质量越大,分子间作用力越大,则晶体的熔沸点越高即晶体熔点由低到高:CF4<CCl4<CBr4<CI4,故A错误;
B.原子半径Si>C,三者都为原子晶体,原子半径越大,共价键的键能越小,则硬度越小,即硬度大小顺序是金刚石>碳化硅>硅,故B错误;
C.Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故C错误;
D.离子半径F-<Cl-<Br-<I-,故离子键强度NaF>NaCl>NaBr>NaI,故晶格能NaF>NaCl>NaBr>NaI,故D正确;
故选D.
点评 本题考查晶体熔沸点大小比较,为高频考点,侧重考查学生分析判断及比较概念能力,明确晶体类型及熔沸点影响因素是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1 mol丙烯醛中含有双键的数目为0.1 NA | |
| C. | 标准状况下,2.24 L乙醇中含有分子的数目为0.1NA | |
| D. | 0.1 mol的氯气全部溶于水后转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
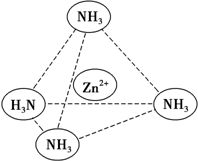 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | C. | $\frac{W}{161(W+18a)}$×100% | D. | $\frac{W}{161(W+36a)}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再发生变化 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
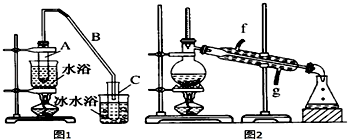

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定同温度下相同浓度的Na2CO3和Na2SO3溶液的pH,前者大于后者,说明碳元素非金属性弱于硫元素 | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 往苯酚的浊液中加入Na2CO3溶液,溶液变澄清,说明酸性:苯酚>HCO3- | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1氨水中c$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,则c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 在0.1 mol•L-1(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)] | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 新鲜肉 | 次鲜肉 | 变质肉 | |
| pH | 5.8-6.2 | 6.3-6.6 | 6.7以上 |
| A. | 不变 | B. | 变强 | C. | 变弱 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com