
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,11.2 L的H2O中含有1.5nA个原子
B.0.1 mol·L-1 的(NH4)2SO4溶液中,所含NH4+数小于0.2nA
C.常温常压下,16 g的O2和O3混合气体中,含有8nA个电子
D.质量相同的N2和CO中,含有2nA个原子
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+ 、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO
、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO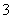 、CO
、CO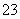 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B.SO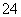
C.CH3COO-  D.HCO
D.HCO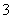
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是____________________。
Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是____________________。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能 大量共
大量共 存的是 ( )
存的是 ( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO 、CO
、CO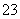
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH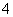 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A.体积相等时密度相等 B.原子数相等时具 有的中子数相等
有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA
B.常温下,14 g C2H4和C3H6的混合气体中含有2NA个氢原子
C.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
D.1 mol甲醇中含有C—H键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为__________________________________________
________________________________________________________________________,
漂白粉的有效成分为________。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2 mol·L-1 NaOH溶液 、2 mol·L-1 HCl溶液、2 mol·L-1 HNO3溶液、0.5 mol·L-1 BaCl2溶液、0.01 mol·L-1 AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
、2 mol·L-1 HCl溶液、2 mol·L-1 HNO3溶液、0.5 mol·L-1 BaCl2溶液、0.01 mol·L-1 AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 | |
| 步骤2:向沉淀加入适量2 mol·L-1 HCl溶液,将产生的气体通入________________________________________________________________________ ________________________________________________________________________ | 现象:________________________________________________________________________ 结论:________________________________________________________________________ |
| 步骤3:取滤液分装A、B两支试管。向A试管,________________________________________________________________________ | 现象:溶液先变红色,然后褪色。 结论:________________________________________________________________________ |
| 步骤4:向B试管,________________________________________________________________________ ________________________________________________________________________ | 现象:产生白色沉淀。 结论:________________________________________________________________________ |
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉b g加水溶解后配制成100 mL溶液,准确量取25.00 mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.100 0 mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00 mL。则该漂白粉中Ca(ClO)2的质量分数为________________________________________________________________________。
(只列算式,不做运算,已知:Mr[Ca(ClO)2]=143;Ca(ClO)2+4HCl===2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2===Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
某钢厂高炉炼铁的主要原料是焦炭、赤铁矿(主要成分是Fe2O3)、空气等。主要反应过程如下图所示:

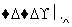


 赤铁矿、高温,
赤铁矿、高温,
(1)在上图方框内写出有关反应生成物的化学式。
(2)写出①②两步反应的化学方程式。
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=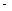 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=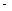 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
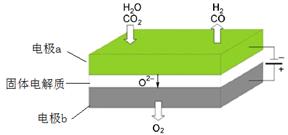
CO2在电极a放电的反应式是_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述I和II均正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com