
| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA |
分析 A、苯不是单双键交替的结构;
B、氢氧化钠溶液中,氢氧根离子抑制了水的电离,水中氢离子是水电离的;
C、燃料电池中正极发生还原反应,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应得到4mol电子;
D、SO2和O2的反应是可逆反应,不能进行彻底.
解答 解:A、苯不是单双键交替的结构,不含双键,故A错误;
B、pH=13的氢氧化钠溶液中氢氧根离子浓度为0.1mol/L,该溶液中氢离子浓度为:1×10-13mol/L,氢氧化钠溶液中的氢离子是水电离的,则水电离的氢氧根离子的物质的量为1×10-13mol,水电离的OH-离子数目为1×10-13NA,故B错误;
C、标况下22.4L气体的物质的量为1mol,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应转移了4mol电子,则电路中通过的电子数目为4NA,故C错误;
D、SO2和O2的反应是可逆反应,不能进行彻底,即不能彻底反应生成2molSO3,故混合气体的物质的量大于2mol,分子数大于2NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业中,加催化剂有利于三氧化硫的生成 | |
| D. | 2SO2+O2$?_{加热}^{催化剂}$2SO3的反应条件不是室温,是500℃左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Al→Al(OH)3 | D. | SiO2→H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物 | |
| B. | PM2.5只是地球大气成分中含量很少的组分,对空气质量和能见度等没什么影响 | |
| C. | PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远 | |
| D. | PM2.5主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| B | 常温下将Fe片放入浓硝酸中 | 无明显变化 | Fe与浓硝酸不反应 |
| C | 将一小块Na放入医用酒精中 | 产生气泡 | Na只置换出醇羟基上的氢 |
| D | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、AlO2-、NO3-、Cl- | B. | K+、Na+、ClO-、Fe2+ | ||
| C. | Na+、I-、NO3-、SO42- | D. | NH4+、Na+、S2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | C17H36 | … | … |
| A. | C16H34 | B. | C22H46 | C. | C26H54 | D. | C27H56 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
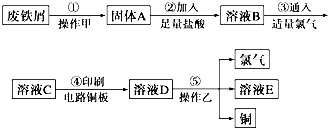
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
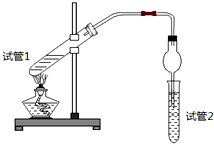 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH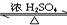 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com