
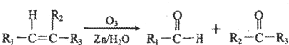
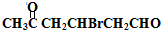 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$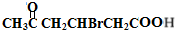 +Cu2O↓+2H2O
+Cu2O↓+2H2O .
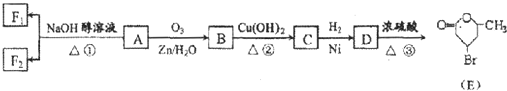
.分析 由E的结构逆推可知D为HOOCCH2CHBrCH2CH(OH)CH3,C为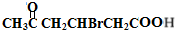 ,1molB与足量的新制Cu(OH)2反应可生成1molC和lmol Cu2O,则B为
,1molB与足量的新制Cu(OH)2反应可生成1molC和lmol Cu2O,则B为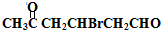 .化合物A由C、H、Br三种元素组成,其相对分子质量为161,只能含有1个Br原子,去掉1个Br后剩余式量为161-80=81,碳原子最大数目为$\frac{81}{12}$=7…9,故A分子中含有7个碳原子、9个H原子、1个Br原子,故A的分子式为C6H9Br,则A的分子式为C6H9Br,A与B的碳原子数目相等,故A应是环状化合物,结合信息可知A的结构简式为
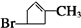
.化合物A由C、H、Br三种元素组成,其相对分子质量为161,只能含有1个Br原子,去掉1个Br后剩余式量为161-80=81,碳原子最大数目为$\frac{81}{12}$=7…9,故A分子中含有7个碳原子、9个H原子、1个Br原子,故A的分子式为C6H9Br,则A的分子式为C6H9Br,A与B的碳原子数目相等,故A应是环状化合物,结合信息可知A的结构简式为  .F1和F2均为较稳定的化合物且互为同分异构体,是A的消去产物,为
.F1和F2均为较稳定的化合物且互为同分异构体,是A的消去产物,为 、
、 .
.
解答 解:由E的结构逆推可知D为HOOCCH2CHBrCH2CH(OH)CH3,C为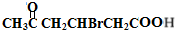 ,1molB与足量的新制Cu(OH)2反应可生成1molC和lmol Cu2O,则B为
,1molB与足量的新制Cu(OH)2反应可生成1molC和lmol Cu2O,则B为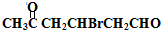 .化合物A由C、H、Br三种元素组成,其相对分子质量为161,只能含有1个Br原子,去掉1个Br后剩余式量为161-80=81,碳原子最大数目为$\frac{81}{12}$=7…9,故A分子中含有7个碳原子、9个H原子、1个Br原子,故A的分子式为C6H9Br,则A的分子式为C6H9Br,A与B的碳原子数目相等,故A应是环状化合物,结合信息可知A的结构简式为
.化合物A由C、H、Br三种元素组成,其相对分子质量为161,只能含有1个Br原子,去掉1个Br后剩余式量为161-80=81,碳原子最大数目为$\frac{81}{12}$=7…9,故A分子中含有7个碳原子、9个H原子、1个Br原子,故A的分子式为C6H9Br,则A的分子式为C6H9Br,A与B的碳原子数目相等,故A应是环状化合物,结合信息可知A的结构简式为  .F1和F2均为较稳定的化合物且互为同分异构体,是A的消去产物,为
.F1和F2均为较稳定的化合物且互为同分异构体,是A的消去产物,为 、
、 .
.
(1)反应①属于消去反应,反应③属于酯化反应或取代反应,故答案为:消去反应;酯化反应或取代反应;
(2)由上述分析可知,A为 ,故答案为:
,故答案为: ;
;
(3)反应②是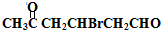 与新制Cu(OH)2悬浊液 反应的方程式为:
与新制Cu(OH)2悬浊液 反应的方程式为: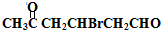 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$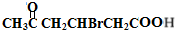 +Cu2O↓+2H2O,
+Cu2O↓+2H2O,
故答案为: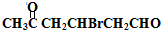 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$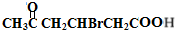 +Cu2O↓+2H2O;
+Cu2O↓+2H2O;
(4)D为HOOCCH2CHBrCH2CH(OH)CH3,D的同分异构体符合条件:①分子中含有一个羧基、三个甲基;②-OH、-Br连在同一个碳原子上,则符合条件的同分异构体为: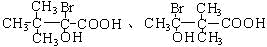 ,其中符合核磁共振氢谱为9:1:1为:
,其中符合核磁共振氢谱为9:1:1为: ,
,
故答案为: .
.
点评 本题考查有机物的推断和合成,注意根据E的结构、结合信息与反应条件采取正逆推相结合的方法推断,对学生的逻辑推理有一定的要求,确定A的结构是关键,熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
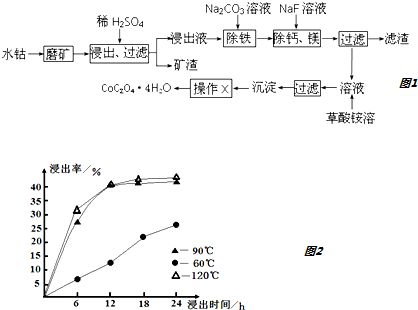
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
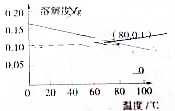
| A. | 熟石灰的溶解是吸热过程 | |
| B. | 温度升高时熟石灰的熔解速率减慢 | |
| C. | 80℃时,熟石灰的Ksp约等于9.8×10-6 | |
| D. | 若硝酸钾中含有少量的熟石灰,可用溶解、过滤的方法进行提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙的阳离子可能不是主族元素 | B. | 乙可能是硝酸铝 | ||
| C. | 甲可能是硫酸钠 | D. | 所得溶液呈弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
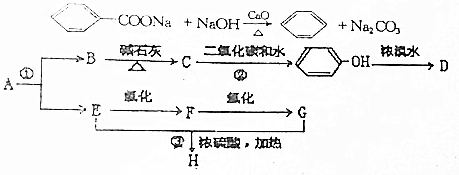
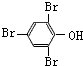 ;化合物H的名称甲酸甲酯.
;化合物H的名称甲酸甲酯.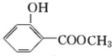 ,
,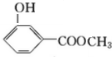 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
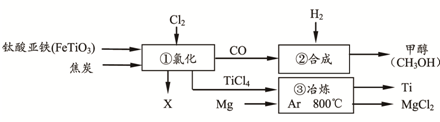
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com