
【题目】某同学欲证明乙炔能与KMnO4酸性溶液反应,实验方案如下:将电石与水反应生成的气体通入KMnO4酸性溶液,溶液褪色,证明二者发生了反应。请回答:
(1)制备乙炔的反应的化学方程式是_______。
(2)该同学的实验方案存在的问题是______。
(3)为了解决上述问题,需重新选择实验装置,备选装置如图所示。
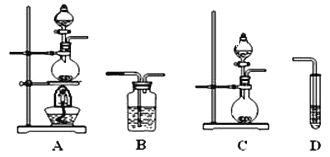
①将装置编号按顺序填在横线上___→B→__________。
②B装置中所盛放的试剂是____________。
(4)乙炔使酸性KMnO4溶液褪色的离子方程式是_____。
【答案】CaC2+2H2O→Ca(OH)2+HC≡CH↑ 电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂 C D 硫酸铜溶液 C2H2+2MnO4﹣+6H+═2CO2+2Mn2++4H2O
【解析】
根据乙炔的性质书写乙炔制备及相关反应方程式;根据实验目的分析实验中装置的作用及所用的试剂。
(1)碳化钙与水反应生成氢氧化钙和乙炔,该反应为CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(2)该同学的实验方案存在的问题是电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂,故答案为:电石含有杂质,反应产生其他还原性气体,干扰乙炔的检验,应除杂;
(3)①固体与液体反应制备乙炔,选择装置C,再利用B装置除杂,最后利用D装置检验乙炔,故答案为:C;D;
②B装置除去硫化氢,则所盛放的试剂是硫酸铜溶液;
(4)乙炔使酸性KMnO4溶液褪色是因为被高锰酸钾氧化生成二氧化碳,反应的离子方程式是C2H2+2MnO4﹣+6H+═2CO2+2Mn2++4H2O。


科目:高中化学 来源: 题型:
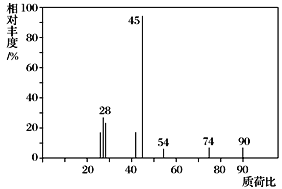
【题目】有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_____。
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是__________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+ H2O2+2H+= I2+O2↑+2H2O
C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
D. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+ Cl-+ 2H+= Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,含氮元素的物质可发生如图所示的循环转化。

回答下列问题:
(1)氮的原子结构示意图为_________。
(2)图中属于“氮的固定”的是_________(填字母,下同);转化过程中发生非氧化还原反应的是_________。
(3)若“反应h”是在NO2与H2O的作用下实现,则该反应中氧化产物与还原产物的物质的量之比为_________。
(4)若“反应i”是在酸性条件下由NO3-与Zn的作用实现,则该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管A中先加入46 g CH3CH2OH,边摇动边缓缓加入2 mL浓硫酸并充分摇匀,冷却后再加入30 g CH3COOH,充分混合后将试管固定在铁架台上,在试管B中加入7mL C溶液。连接好装置用酒精灯对试管A加热,当观察到试管B中有明显现象时停止加热。
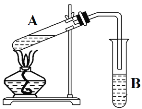
(1)浓硫酸的作用是__________
(2)B装置中观察到的现象是______
(3)溶液C为_________, B中导管未插入液面以下,其原因是__________
A 饱和NaOH溶液 b 水 c 饱和Na2CO3溶液d CCl4
(4)最后通过分离提纯得到乙酸乙酯 30.8 g ,则乙酸乙酯的实际产率是____(实际产率 = ![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素基态原子电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5.则下列有关比较中正确的是
A. 单电子数:③>① B. 原子半径:④>③
C. 电负性:②>① D. 最高正化合价:④>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是_______(填元素符号,下同)、非金属性最强的是______,用电子式表示上述两种元素形成化合物的过程___________。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_______________,其氢化物的电子式是___________________________。
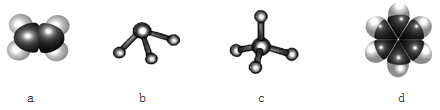
(3)元素①和③可以形成多种化合物。下图模型表示的分子中,可能由①和③形成的是_____________________________________________________(请用结构简式作答)。
(4)元素③、⑤的最高价氧化物对应水化物中酸性较强的是_________(填化学式),说明你判断的理由:____________________________________________________。
(5)主族元素砷(As)的部分信息如图所示。
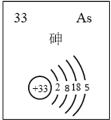
①砷(As)在周期表中的位置是________________。
②下列说法正确的是_______(填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.⑥的气态氢化物的还原性大于砷的气态氢化物的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
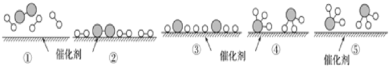
A.使用催化剂,改变了反应的途径,使合成氨反应放出的热量减少
B.该过程中,N2、H2吸收能量后断键形成N原子和H原子
C.该过程中,N原子和H原子形成含有非极性键的NH3分子
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
A. ![]() 的摩尔质量是32
的摩尔质量是32
B. ![]() 和
和![]() 互称为同位素
互称为同位素
C. 1mol ![]() 含质子数约为32×6.02×1023
含质子数约为32×6.02×1023
D. 由质量数可以判断其在周期表的位置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com