
科目:高中化学 来源: 题型:选择题
| A. | 18O存在于所有物质中 | B. | 有的乙醇分子可能不含18O | ||
| C. | 所得酯的相对分子质量为88 | D. | 18O仅存在于乙醇和乙酸乙酯里 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
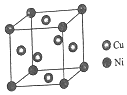 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M | N | ||
| X | Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液:Fe3+、NH4+、Cl-、NO3- | |
| B. | 水电离出的c(H+)=$\sqrt{{K}_{w}}$的溶液中:Na+、SO42-、CO32-、K+ | |
| C. | 由水电离出的c(OH-)=1.0×10-2 mol•L-1的溶液:Cl-、CH3COO-、K+、[Al(OH)4]- | |
| D. | $\frac{[O{H}^{-}]}{[{H}^{+}]}$=1012的溶液中,NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
| 1 | 7.24 | 50.00 | 1.792 |
| 2 | 14.48 | 50.00 | 3.584 |
| 3 | 21.72 | 50.00 | 4.032 |
| 4 | 36.20 | 50.00 | 2.240 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com