
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B. C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是只含碳、氢、氧三元素的有机物,是高效的抗疟药,为无色针状晶体,易溶于乙醚中,在水中几乎不溶,熔点为156~157℃,已知乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础,以乙醚浸取法的主要工艺如图所示:

回答下列问题:
(1)选用乙醚浸取青蒿素的原因是______。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃棒和________ ,操作Ⅱ的名称是__________,操作Ⅲ利用青蒿素和杂质在同一溶剂中的溶解性差异及青蒿素溶解度随温度变化较大的原理提纯,这种方法是______________。
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:
A.  B.
B.  C.
C.  D.
D.  E.
E. 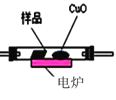
①按上述所给的测量信息,装置的连接顺序应是_____________。(装置可重复使用)
②青蒿素样品的质量为28.2g,用连接好的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最简式是_____________。
③要确定该有机物的分子式,还必须知道的数据是_________,可用__________仪进行测定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A.密度:CCl4>H2O>苯
B.同质量的物质燃烧耗 O2 量:丙炔>乙炔>甲烷
C.熔点:戊烷>2,2 -二甲基戊烷>2,3 -二甲基丁烷>丙烷
D.同物质的量物质燃烧耗 O2 量:己烷>环己烷>苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烷脱氢制异丁烯反应为:![]() △H1=+124kJ·mol-1,副反应为裂解反应:
△H1=+124kJ·mol-1,副反应为裂解反应:![]() △H2=+84kJ·mol-1,异丁烷的转化率(%)随温度和压强的变化如图,下列说法不正确的是
△H2=+84kJ·mol-1,异丁烷的转化率(%)随温度和压强的变化如图,下列说法不正确的是
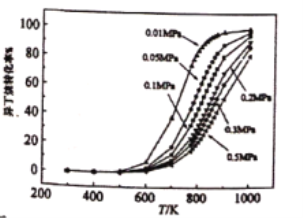
A.由图可知,600~1000K范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
B.在不同温度、压强下,转化相同物质的量的异丁烷所需要的时间相等
C.使用催化剂可以加快反应速率,从而缩短反应达到平衡所需的时间
D.开发合适的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )

A.1mol 绿原酸与足量 NaHCO3 溶液反应,生成 3molCO2 气体
B.1mol 绿原酸与足量 Na 反应,最多消耗 6molNa
C.1mol 绿原酸与足量 NaOH 溶液反应,最多消耗 3molNaOH
D.绿原酸水解产物均可以与 FeCl3 溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E是生活中最坚硬的金属。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E是生活中最坚硬的金属。回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)电负性最大的元素是__;
(2)D的氢化物比C的氢化物的沸点__(填"高"或"低"),原因__;
(3)写出E元素的电子排布式__,已知元素周期表可按电子排布分为s区、p区等,则E元素在__区;
(4)A、B、C最高价氧化物的晶体类型是分别是___晶体,__晶体,__晶体;
(5)画出D的核外电子排布图___,这样排布遵循了__原理和___规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:

已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)反应①的化学方程式是__。
(2)B的官能团是__。
(3)F是一种高分子,可用于制作食品袋,其结构简式为__。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,某学习小组在实验室制取乙酸乙酯的主要步骤如下:
i.配制2mL浓硫酸、3mLD(含18O)和2mLE的混合溶液。
ii.按如图连接好装置并加入混合液,用小火均匀加热3~5min。

iii.待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
iv.分离出乙酸乙酯,洗涤、干燥。
回答问题:
①装置中球形干燥管,除起冷凝作用外,另一重要作用是___。
②步骤②安装好实验装置,加入药品前还应检查__。
③反应中浓硫酸的作用是__;写出能表示18O位置的制取乙酸乙酯的化学方程式:__。
④上述实验中饱和碳酸钠溶液的作用是__(填字母)。
a.中和乙酸并吸收乙醇
b.中和乙酸和乙醇
c.降低乙酸乙酯的溶解度
d.加速酯的生成,提高其产率
⑤步骤③所观察到的现象是__;从试管乙中分离出乙酸乙酯的实验操作名称是___。
制法二:工业上用CH2=CH2和E直接反应获得G。
a.反应类型是__。
b.与制法一相比,制法二的优点是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com