
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 在试管中滴入适量C2H5X与NaOH溶液,振荡、加热、静置分层后,取水层加稀硝酸酸化,再滴加数滴AgNO3溶液 | 生成淡黄色沉淀 | 证明卤代烃中含有溴元素 |
| B | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| C | 将澄清石灰水滴入可能混有Na2CO3的NaHCO3溶液中 | 有白色沉淀产生 | 该溶液中一定含有Na2CO3 |
| D | 在简易启普发生器中向石灰石中加入浓醋酸,将产生的气体直接通入Na2SiO3溶液中 | 硅酸钠溶液产生白色胶状物质 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.卤代烃在碱性溶液中水解生成溴离子,加稀硝酸酸化的AgNO3溶液,反应生成淡黄色的AgBr;
B.浓氨水与具有挥发性的浓酸反应生成固体;
C.碳酸钠和碳酸氢钠都能和澄清石灰水反应生成碳酸钙沉淀;
D.强酸能和弱酸盐反应生成弱酸,醋酸具有挥发性,醋酸也能和Na2SiO3反应生成硅酸.
解答 解:A.卤代烃在碱性溶液中水解生成溴离子,加硝酸调节至酸性条件下,滴加AgNO3溶液,反应生成AgBr,观察到出现淡黄色沉淀,说明卤代烃中含有溴元素,故A正确;
B.浓氨水与具有挥发性的浓酸反应生成固体,由现象可知,酸为浓盐酸、浓硝酸等,故B错误;
C.碳酸钠和碳酸氢钠分别和氢氧化钙反应的方程式如下:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH、NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH,所以都能发生复分解反应生成沉淀,故C错误;
D.强酸能和弱酸盐反应生成弱酸,醋酸具有挥发性,所以制取的二氧化碳中含有醋酸,醋酸也能和Na2SiO3反应生成硅酸,所以不能据此判断酸性:醋酸>碳酸>硅酸,故D错误.
故选A.
点评 本题考查化学实验方案评价,为高考高频点,侧重考查基本原理、离子检验等知识点,明确元素化合物知识、物质性质即可解答,易错选项是D,注意排除醋酸的干扰,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.3 mol/(L•min) | B. | υ(B)=0.6 mol/(L•min) | ||
| C. | υ(C)=0.5 mol/(L•min) | D. | υ(A)=0.01 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
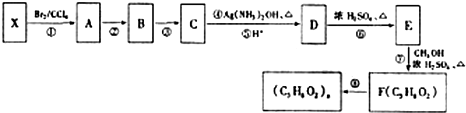
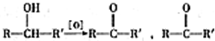 不易被氧化成羧酸
不易被氧化成羧酸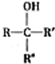 不易被氧化成醛或酮
不易被氧化成醛或酮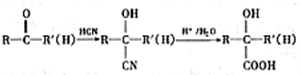
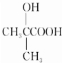 .
.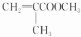 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$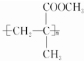 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.根据图示转化关系回答:
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.根据图示转化关系回答: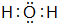 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R、R′代表烃基)
(R、R′代表烃基)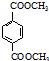 有多种同分异构体,同时满足下列条件的同分异构体有8种.
有多种同分异构体,同时满足下列条件的同分异构体有8种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 配制0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85gNaCl | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com