
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为________________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
________________________________________________________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为____________。
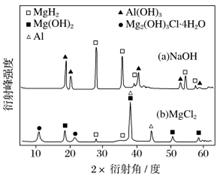
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是__________(填化学式)。
答案 (1)②Al4C3+12HCl===4AlCl3+3CH4↑
(2)①防止Mg、Al被空气氧化 ②52 mol ③Al
解析 (1)含氢量最高的烃为CH4,据此可知Al4C3与盐酸发生的反应为Al4C3+12HCl===4AlCl3+3CH4↑。
(2)①Mg、Al都是活泼金属,高温时易与空气中的O2反应,通入氩气的目的是隔绝空气,防止Mg、Al被氧化。②1 mol Mg17Al12完全吸氢后得到的混合物Y中含有17 mol MgH2和12 mol Al,与6.0 mol·L-1盐酸反应时,生成MgCl2、AlCl3和H2,则生成H2的物质的量为17 mol+17 mol+12 mol× =52 mol。
=52 mol。
③X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同。由图可知,在NaOH溶液中,不存在Al、Mg(OH)2和Mg2(OH)3Cl·4H2O的衍射峰,即不存在Al、Mg(OH)2和Mg2(OH)3Cl·4H2O,据此推知,混合物Y中Al与NaOH溶液反应产生H2,MgH2未发生反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列事实能用键能大小来解释的是( )
①N2的化学性质比O2稳定 ②金刚石的熔点高于晶体硅 ③惰性气体一般难发生化学反应 ④通常情况下,溴呈液态,碘呈固态
A.①② B.①③
C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中含有K+、Cl-、OH-、SO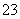 、SO
、SO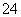 ,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
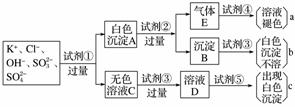
(1)图中试剂①~⑤溶质的化学式分别是
①________,②________,③________,④__________,
⑤__________。
(2)图中现象a、b、c表明检验出的离子分别是
a________、b________、c________。
(3)白色沉淀A加试剂②反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(4)无色溶液C加试剂③的主要目的是________________________________________________________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(6)气体E通入试剂④发生反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.向氯化铝溶液中通入过量氨气:4NH3+Al3++2H2O===AlO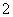 +4NH
+4NH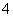
B.将铝片打磨后置于NaOH溶液中:2Al+2OH-===2AlO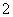 +H2↑
+H2↑
C.向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO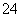 +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO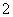 +2H2O
+2H2O
D.向NaAlO2溶液中通入足量CO2:AlO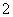 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO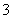
查看答案和解析>>
科目:高中化学 来源: 题型:
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO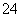 的物质的量之比为( )
的物质的量之比为( )
A.1∶3 B.2∶3 C.6∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是______________________________
________________________________________________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是__________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com