
【题目】三氯氧磷(POCl3)常温下为无色液体,有广泛应用。近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到)。
(1)氧气直接氧化法产生三氯氧磷的化学方程式是________________;从原理上看,与氯化水解法相比,其优点是____________________。
(2)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰将磷元素转化为磷酸的钙盐沉淀并回收。
①漂白粉的主要作用是__________________________。
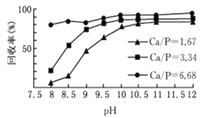
②下图表示不同条件下对磷的沉淀回收率的影响(“Ca/P”表示钙磷比,及溶液中Ca2+与PO43-的浓度比),则回收时加入生石灰的目的是__________________________。
(3)下述方法可以测定三氯氧磷产品中氯元素含量,实验步骤如下:
Ⅰ.先向一定量产品中加入足量NaOH溶液,使产品中的氯元素完全转化为Cl-;
Ⅱ._________________________;
Ⅲ.再加入少量硝基苯并振荡,使其覆盖沉淀,避免沉淀与水溶液接触;
Ⅳ.最终加入几滴NH4Fe(SO4)2溶液后,用NH4SCN溶液沉淀溶液中过量的Ag+,并记录NH4SCN的用量。
已知相同条件下的溶解度:AgSCN<AgCl。
①步骤Ⅱ的操作为_______________________。
步骤Ⅳ中当溶液颜色变为____________色时,即表明溶液中的Ag+恰好沉淀完全
②若取消步骤Ⅲ,会使步骤Ⅳ中增加一个化学反应,该反应的离子方程式是________________;该反应使测定结果偏低,运用平衡原理解释器原因:___________________。
【答案】 ⑴ 2PCl3+O2=2POCl3 原子利用率高(或无副产物,对环境污染小等合理答案均给分)
⑵① 将H3PO3氧化为H3PO4 ②增大钙磷比和废水的pH,从而提高磷的回收率
⑶用硝酸酸化后,加入过量的AgNO3溶液,使Cl-完全沉淀 ①记录AgNO3用量 红
②AgCl+SCN-=Ag SCN+Cl- AgCl在溶液中存在沉淀溶解平衡,加入NH4SCN溶液后,生成AgSCN沉淀使AgCl的溶解平衡向右移动,NH4SCN消耗量增大
【解析】(1)依据题干要求,PCl3和O2反应生成三氯氧磷的方程式为:2PCl3+O2=2POCl3;因该反应无副产物,原子利用率高,且对环境污染小,故比氯化水解法要好;
(2)①在该废水中加入漂白粉,可以将+3价的磷氧化为+5价;
②加入生石灰是为了增大钙磷比和废水的pH,有利于将磷元素转化为磷酸的钙盐沉淀,从而提高磷的回收率;
(3)①要先加入硝酸将NaOH中和,然后加入硝酸银,将氯离子沉淀,记录硝酸银的用量; 滴定完全时,Ag+全部生成AgSCN沉淀,过量的SCN-和Fe3+结合,溶液变为红色;
②因AgCl在溶液中存在平衡:AgCl(s)Ag+(aq)+Cl-(aq),加入NH4SCN溶液时,AgCl会和SCN-结合,生成更难溶的AgSCN,即:AgCl+SCN-=AgSCN+Cl-生成AgSCN沉淀使AgCl的溶解平衡向右移动,导致NH4SCN消耗量增大。


科目:高中化学 来源: 题型:
【题目】在下列转化关系中,烃A为石油的裂解气里含是较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4LH2(标准状况);E为六元环化合物。请回答下列问题:

(1)写出A 的结构简式____________。
(2)①的反应类型为___________。
(3)D物质中含氧原子团的名称为___________;写出HOCH2CH2OH与金属钠反应的化学方程式___________。
(4)写出反应②的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L的H2和CO2混合气体中含有的分子总数为NA
B.常温常压下,24g金属镁变为镁离子时得到的电子数为2NA
C.标准状况下,5.6L水含有的分子数为0.25NA
D.1 mol Cl2与足量Fe反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或实验事故处理不正确的是( )
A. 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中
B. 除去苯中的苯酚杂质,可加入NaOH溶液后静置分液
C. 不慎将苯酚沾到手上,应立即用酒精洗涤,再用水冲洗
D. 实验室制乙酸丁酯时,必须用水浴加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.B.C.D.E五种烃分子中均含有8个氢原子,其中A.B常温下呈气态,C.D.E呈液态。
(1)A是符合上述条件中相对分子质量最小的,则A的分子式为________;B属于链状单烯烃,且与HBr加成的产物只有一种,试写出B的结构简式________
(2)C属于芳香烃,可用来制烈性炸药,试写出C制取烈性炸药的方程式____________________________________________________________
(3)已知E的结构简式为 ![]() 存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和______ mol的H2加成,写出E的所有一氯代物的结构简式_____________________________
存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和______ mol的H2加成,写出E的所有一氯代物的结构简式_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200 ml Fe2(SO4)3溶液中含Fe3+ 56g,溶液中SO42-的物质的量浓度是( )
A.7.5 mol/L
B.5mol/L
C.10 mol/L
D.2.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉、铜粉、 FeCl3 溶液和 CuCl2 溶液混合在试管中充分反应,若过滤后滤渣能被磁铁吸引,则下列有关叙述正确的是( )
A.溶液中肯定不存在的离子只有 Cu2+ B. Fe3+和 Cu2+均能被铁粉还原
C.滤液中滴加 KSCN 溶液显红色 D.滤渣中肯定不含有铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
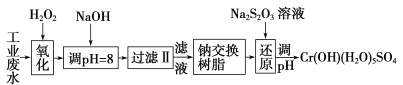
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8g Cr2O72-转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。
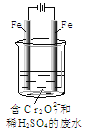
(1)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因_________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化化成沉淀的质量是________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com