
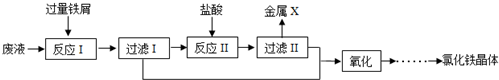
分析 废液中加入过量铁屑,参加反应的离子为Fe3+、Cu2+,生成Fe2+、Cu,过滤后将固体加入足量盐酸,可除去Fe生成Fe2+,金属X为Cu,两次过滤所得滤液加入氯水,氧化Fe2+生成Fe3+,然后在氯化氢的氛围中蒸发结晶得到氯化铁晶体,以此解答该题.
解答 解:废液中加入过量铁屑,参加反应的离子为Fe3+、Cu2+,生成Fe2+、Cu,过滤后将固体加入足量盐酸,可除去Fe生成Fe2+,金属X为Cu,两次过滤所得滤液加入氯水,氧化Fe2+生成Fe3+,然后在氯化氢的氛围中蒸发结晶得到氯化铁晶体,
(1)由以上分析可知X为Cu,可被铁置换生成,且与盐酸不反应,过滤可得,故答案为:Cu;
(2)废液中含有氯化铁与氯化铜,均与铁反应,故“反应Ⅰ”中反应有:2FeCl3+Fe═3FeCl2、CuCl2+Fe=FeCl2+Cu,其中2FeCl3+Fe═3FeCl2不属于置换反应,
故答案为:2FeCl3+Fe═3FeCl2;
(3)氯气具有强氧化性,可与亚铁离子发生氧化还原反应,反应的离子方程式为2Fe3++Cl2=2Fe2++2Cl-,故答案为:2Fe3++Cl2=2Fe2++2Cl-.
点评 本题考查物质的制备和分离、提纯,为高考常见题型,题目难度中等,注意掌握金属回收方法、常见的离子之间的反应,明确离子方程式的书写方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
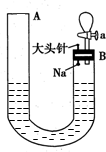 如图是有关钠与水反应及产物检验的实验装置.实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中.回答下列问题:
如图是有关钠与水反应及产物检验的实验装置.实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
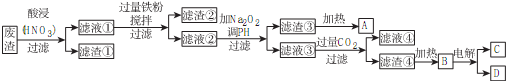
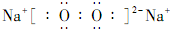 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在汽油中加入乙醇热值改变 | |
| B. | 秸秆燃烧是造成雾霾的原因之一 | |
| C. | 用牺牲阴极的方法可以保护金属 | |
| D. | 自行车钢架生锈主要是电化学腐蚀所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A与B的相对分子质量之比为m:n | |
| B. | 同温同压下,两气体A与B的密度之比为n:m | |
| C. | 同质量的A与B分子个数之比为m:n | |
| D. | 相同状况下,同体积的气体A与B 质量比为m:n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com