
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
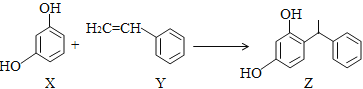
下列叙述正确的是( )。
A. X、Y和Z均能使溴水褪色,且原理相同
B. X和Z均能与Na2CO3溶液反应放出CO2
C. X、Y和Z分子中的所有原子可能共平面
D. X苯环上一氯代物有3种,Y苯环上的二氯代物有6种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氧化铁红(Fe2O3)用途广泛,用废铁皮制取铁红的部分流程示意图如下:
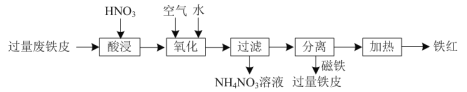
⑴“酸浸”时发生反应的离子方程式是______。
⑵“氧化”时有红褐色沉淀生成,该反应的离子方程式为______。
⑶将铁红与FeS2混合焙烧可以生成磁性氧化铁和SO2,该反应的化学方程式为______。
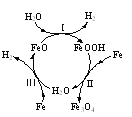
⑷“淬火”是将红热的铁器浸入水中急速冷却以增加铁器的硬度以及减缓腐蚀,反应历程如图,写出该历程中第Ⅰ步反应的方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)![]() 2HI(g)。
2HI(g)。
(1)保持容器容积不变,向其中充入1molHe,反应速率________(填“加快”“减慢”或“不变”,下同)。
(2)保持容器内气体压强不变,向其中充入1molHe,反应速率________。
II.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,氢氧燃料电池以KOH溶液为电解质,其总反应的化学方程式为2H2+O2=2H2O。
(3)负极上的电极反应为______________________________。
(4)工作过程中时,溶液的c(OH-)_______(填“增大”、“减小”或“不变”)。
Ⅲ..A、B、C、D、E、W、T六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子。B原子的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,W的L层电子数为K层和M层电子数之和,D和W同主族。回答下列问题:
(5)元素B在周期表中的位置是_______________________。
(6)元素C的原子结构示意图为_______________________。
(7)元素C与W可形成CW2,C与T可形成CT4,这两种化合物均可做溶剂,其电子式分别为____________________________________。
(8)元素A与D、E形成10电子分子的结构式分别为_______________________________。
(9)元素D、W的简单氢化物的沸点高的为____________(用化学式表示)。
(10)1molCA4与D2完全反应生成两种气体时放出热量802kJ,则该反应的热化学方程式为__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A.煤燃烧时加入适量石灰石,可减少SO2的排放
B.泡沫灭火器可用于一般的起火,也适用于电器起火
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.铵态氮肥不宜跟碱性物质如草木灰混合使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A. 氢氧燃料电池工作时,![]() 在负极上失去电子
在负极上失去电子
B. ![]() 溶液加热后,溶液的pH减小
溶液加热后,溶液的pH减小
C. 常温常压下,![]() 中含有的分子数为
中含有的分子数为![]() 个
个
D. 室温下,稀释![]() 溶液,溶液的导电能力增强
溶液,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到1.12 L标准状况下的气体(假设只有NO2、NO),则反应消耗的硝酸的物质的量可能是
A.0.11 molB.0.1 molC.0.09 molD.0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
方案I取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度

(1)乙中发生反应的方程式为____________。
(2)仪器接口的连接顺序为(装置可以重复使用)a___________,丁的作用是__________。
(3)当样品充分反应完后,缓慢通入空气的目的是:____________。
方案Ⅱ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g/。
(4)下列仪器中,该方案不会用到的是____________。

(5)判断样品完全分解的方法是_______;本实验至少需要称量_______次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 +SiO2![]() MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
MgSiO3 +CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______。(填“正确”或“错误”)请说明理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象、结论均完全正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 在常温下测定Na2CO3和NaHCO3溶液的pH | Na2CO3溶液pH较大 | 水解能力:Na2CO3大于NaHCO3 |
B | 先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。 | 滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成 | AgCl沉淀可转化成AgI沉淀 |
C | 电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极 | 润湿的淀粉—碘化钾试纸变蓝 | 阳极产生Cl2 |
D | 饱和FeCl3溶液中加入少量NaCl固体 | 溶液颜色变浅 | 加入NaCl固体后,FeCl3的水解平衡逆向移动 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa。25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1 NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法不正确的是

A. a点溶液中:c(HA-)=c(H2A)
B. b点溶液中:A2-水解平衡常数Kh1=10-6.81
C. c点溶液中:V0=30
D. a、b、c、d四点中,d点溶液中水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com