
分析 氨气为极性分子,水为极性分子,依据相似相溶原理可知氨气极易溶于水;
氮原子非金属性强,氨气分子与水分子间能够形成氢键,氢键的存在能够大大增强氨气的溶解度;
部分氨气与水反应,降低了NH3浓度,使溶解量增大;
离子晶体熔沸点高低取决于离子键的强弱,离子键强弱与阴阳离子半径和大小有关.
解答 解:氨气极易溶于水的原因:1、NH3和H2O极性接近,依据相似相溶原理可知,氨气在水中的溶解度大;
2、氨分子和水分子间可以形成氢键,大大增强溶解能力;
3、部分氨气与水反应,降低了NH3浓度,使溶解量增大;
故答案为:1、NH3和H2O极性接近,依据相似相溶原理可知,氨气在水中的溶解度大;
2、氨分子和水分子间可以形成氢键,大大增强溶解能力;
3、部分氨气与水反应,降低了NH3浓度,使溶解量增大;
钠离子与钾离子带电荷相同,钠离子半径小与钾离子半径,作用力大,离子键强,所以熔点要更高;
故答案为:氯化钠、氯化钾晶体类型相同,钠离子半径小于钾离子,离子键强,所以熔沸点高.
点评 本题考查了物质的溶解度与离子晶体熔沸点规律,熟悉氢键对物质溶解性的影响是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当a和b用导线连接时,溶液中的SO42-向铜片附近移动 | |
| B. | 将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 | |
| C. | 当a和b用导线连接时,铜片上发生的反应为:2H++2e→H2↑ | |
| D. | a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
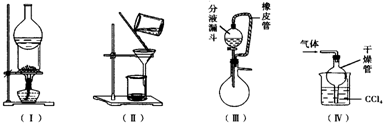 下列实验装置用途正确的是( )
下列实验装置用途正确的是( )| A. | 装置(Ⅰ)可用于I2与NH4Cl混合物的分离 | |
| B. | 装置(Ⅱ)用于分离Fe(OH)3胶体和FeCl3溶液 | |
| C. | 装置(Ⅲ)橡皮管起到平衡气压,使液体顺利流下的作用 | |
| D. | 装置(Ⅳ)用于吸收HCl或NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com