
| 实验编号 | C(I-)/mol?L | C(S2O82-)/mol?L | t/s |
| 1 | 0.040 | 0.040 | 88.0 |
| 2 | 0.080 | 0.040 | 44.0 |
| 3 | 0.080 | 0.080 | 22.0 |
| 4 | 0.160 | 0.020 | 44.0 |
| 5 | 0.120 | 0.040 | 29.3 |
| A、该实验的目的是研究 I- 与S2O82- 的浓度对反应速率的影响 |
| B、I-的浓度越大,反应速率越快 |
| C、S2O82- 的浓度越小,反应速率越快 |
| D、5个实验中,编号3对应浓度的实验,反应速率最快 |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
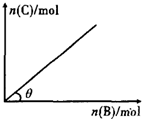 一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )
一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、增加A的物质的量,正反应速率加快 |
| B、平衡时,其他条件不变,当温度升高时,θ变大 |
| C、图中曲线的斜率表示反应的化学平衡常数 |
| D、平衡时,其他条件不变,再通入B,则反应混合物的温度升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤炭经气化,液化和干馏等过程,可获得清洁能源和重要的化工原料 |
| B、漂白粉和漂粉精不仅可以漂白棉,麻,纸张,还可做环境消毒剂 |
| C、Fe3O4俗称铁红,常做红色油漆和涂料 |
| D、蛋白质、淀粉、纤维素均属于天然有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验目的 | |
| A | 取某溶液少许,依次加入BaCl2和稀盐酸 | 确定该溶液中含有SO42- |
| B | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠中含有醛基 |
| C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中滴加稀盐酸有气泡产生. | 确定常温下BaCO3的溶解度比BaSO4小 |
| D | 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的溴离子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A、氢氧燃料电池是一种具有应用前景的绿色电源 |
| B、该电池的总反应:2H2+O2=2H2O |
| C、外电路中电子由电极b通过导线流向电极a |
| D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2与H2O的反应:Cl2+H2O=2H++Cl-+ClO- |
| B、FeCl3溶液与KI溶液跑反应:Fe3++2I-=Fe2++I2 |
| C、Cu与稀硝酸的反应:Cu+2H++NO3-=Cu2++NO↑+H2O |
| D、Al2O3与NaOH溶液的反应:Al2O3+2OH-+3H2O=2[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3 |
| B、NaHSO4 |
| C、Na2CO3 |
| D、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )| A、b处无色碘化钾溶液先变蓝色后变为无色,体现氯气和HClO的漂白性 |
| B、a处无色溴化钾溶液渐变成橙黄色,说明氯的非金属性强于溴 |
| C、c处氢氧化钠酚酞溶液的红色渐渐褪去,可能体现HCl的酸性或HClO的漂白性 |
| D、d处硫酸亚铁溶液呈红色,说明氯气氧化性强于Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com